ニュース
![]() 2023.04.14
2023.04.14
【研究成果】20種類の翻訳因子を再生産しながらDNAを複製する人工分子システムを開発 ――自律的に増殖する人工細胞構築に活路を開く――
東京大学
科学技術振興機構(JST)
発表のポイント
- 細胞が増殖するためには、細胞を構成する全ての成分(DNA、RNA、タンパク質など)を再生産する必要があるが、この能力を持つ人工物はいまだ作られていない。
- 本研究では、タンパク質の翻訳にかかわる20種類のアミノアシルtRNA合成酵素(aaRS)をDNAから再生産させながら、短期間ではあるがDNAの複製を続けることに世界で初めて成功した。
- このシステムに遺伝子を追加することで、将来的には増殖する人工細胞の構築が可能となり、効率的な有用物質生産への貢献が期待される。
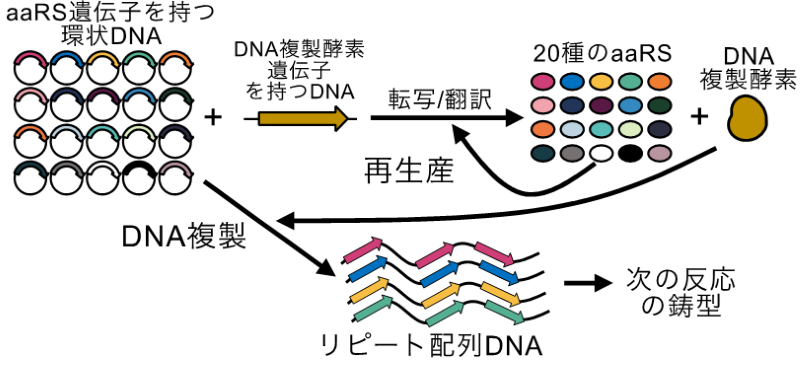
発表概要
東京大学大学院総合文化研究科広域科学専攻の萩野勝己大学院生、市橋伯一教授(同研究科附属先進科学研究機構/同大学生物普遍性連携研究機構)らは、核酸やタンパク質といった無生物材料のみを用いて、生物の特徴である「DNAとタンパク質の再生産の仕組み」を部分的に持つ人工分子システムの構築に世界で初めて成功しました。
生物のように栄養をあたえるだけで増え続ける人工物は未だ作られていません。それは、細胞を構成する全ての成分を再生産できる反応系を作ることができていないためです。本研究グループは、Phi29 DNA複製酵素(注1)を用いた人工DNA複製系と大腸菌由来の無細胞翻訳系(注2)を組み合わせることで、タンパク質の翻訳に必要な20種類のアミノアシルtRNA合成酵素(aaRS)(注3)とそれをコードしたDNAを4世代にわたり再生産し続けることに成功しました。
今回開発した人工分子システムに転写翻訳に必要な遺伝子をさらに追加していくことで、将来的にはアミノ酸や塩基などの低分子化合物をあたえるだけで自律的に増殖する人工細胞へと発展させることができます。そのような人工細胞ができれば、現在行われている医薬品開発や食料生産のような生物を使った有用物質生産がより安定で制御しやすいものになると期待できます。
発表内容
〈研究の背景〉
栄養をあたえるだけで自律的に増える能力は、生物と非生物を隔てる最大の特徴の一つです。生物はこの稀有な能力を持っているため、食料や医薬品の安価な生産に利用されてきました。しかし、生物は人間に都合よくはできていません。品種改良や遺伝子改変にも手間と時間がかかり、改良できる要素も限定的です。もし、生物のように増える能力を持つ分子システムを作ることができれば、生物よりも効率的かつ安定的に制御性の高い有用物質生産を行うことができると期待されています。
生物が自身のコピーを作り続けるためには、自身の設計図であるゲノムDNAを複数世代に渡って複製し続けることが必要です。このゲノム複製反応は、ゲノムに書き込まれた情報(遺伝子)の読み取り(転写・翻訳)により合成したRNAやタンパク質を介した化学反応により起きます。一方で、遺伝情報の読み取り反応である転写・翻訳にも多数のRNAやタンパク質が必要です。つまり持続的に増え続けるためには、ゲノムDNAが複製されるだけでは不十分であり、次の世代でも遺伝情報の読み取りができるように転写・翻訳にかかわるRNAやタンパク質を再生産する必要があります。これまでに、本研究グループではウイルスの持つDNA複製酵素を用いて、転写・翻訳反応と共役したゲノムDNA自己複製反応の再構成に成功しています(Okauchi et al. ACS Synthetic Biology, 2021)。しかし、この系では転写・翻訳に必要なRNAとタンパク質は毎回外部から供給していました。また、転写・翻訳に必要なタンパク質の再生産は海外の複数のグループが試みていますが、同時再生産に成功したタンパク質は多くても13種類までに限られており、さらにそのタンパク質を使ったゲノムDNAの複製には成功していません。
〈研究の内容〉
本研究グループはこれまでに開発したDNA複製系を拡張することで、DNAとタンパク質を再生産する分子システムの構築を試みました。このDNA複製系では、無細胞翻訳系により発現したPhi29 DNA複製酵素により環状DNAやリピート構造を持つDNAを持続的に複製させることができます(Okauchi et al. ACS Synthetic Biology, 2020)。この系の利点は、必要な遺伝子をDNAに載せることにより反応系内で転写・翻訳・DNA複製を同時に行えることにあります。そこで本研究では、転写・翻訳に必要なタンパク質のうちリボソームを除き約半数を占める20種類のアミノアシルtRNA合成酵素(aaRS)の遺伝子をDNAに載せることで、DNAを複製させながらaaRSタンパク質を供給し、そのDNAとaaRSを使ってさらに翻訳を続けること(すなわちDNAとaaRSの再生産)を試みました(図1)。

まず、DNAの複製と1種類のaaRSの再生産が同時に行えるかを継代実験を用いて検証しました(図2)。この継代実験では、1回目の反応は完全な無細胞翻訳系を使って対象のaaRSを翻訳させます。その後、対象のaaRSを含まない無細胞翻訳系を用いて1回目の反応液を継代します。もし、1回目の反応で遺伝子発現に必要な量のaaRSが十分に翻訳されていれば、継代後もDNAの複製が持続します。この実験を全てのaaRSを1種類ずつ行なったところ、aaRS遺伝子を持たないDNA(対照区、代わりにGFP遺伝子を持つ)では継代するにつれてDNA複製が停止しましたが、aaRS遺伝子を持つDNAではDNA複製が維持されました(図2)。この結果より、1種類のaaRSを用いてDNA複製とタンパク質の再生産を同時に行えることが示されました。
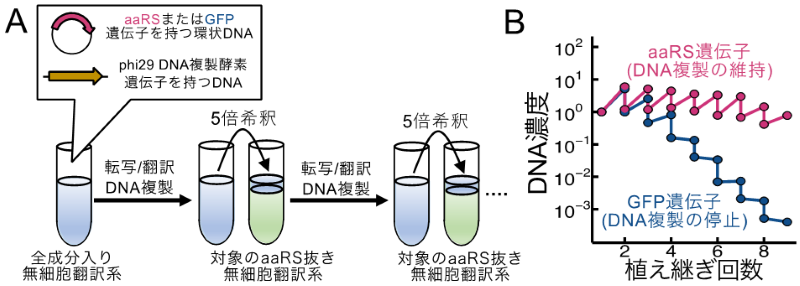
(B) 結果の一例(AlaRSの再生産)。AlaRS-DNAを反応させた場合(赤線)はAlaRSの再生産によりDNA複製が維持される。一方で、GFP-DNAを反応させた場合(青線)は植え継ぎにより対象のaaRSが枯渇し、DNA複製が停止する。
続いて、この系を拡張し20種類全てのaaRSを同時に再生産しながらDNA複製が持続できる系の構築を試みました。しかし、15種類以上のaaRSを同時に再生産させた段階で無細胞翻訳系のタンパク質合成能力の低さから、十分量の再生産ができずDNA複製が停止してしまいました。そこで本研究グループは、1)反応液を透析膜に封入し外部溶液から低分子化合物を供給し続けること、2)発現量の少ないaaRSについて遺伝子配列の改変により発現量を増加させること、3)各aaRSをコードしたDNAのコピー数を必要なaaRS濃度に応じて調整すること、という三つの工夫により、全てのaaRSが十分量再生産されるようにしました。その結果、遺伝子発現に必要な20種類全てのaaRSを同時に再生産しながらDNA複製を4世代に渡って維持することに世界で初めて成功しました(図3)。
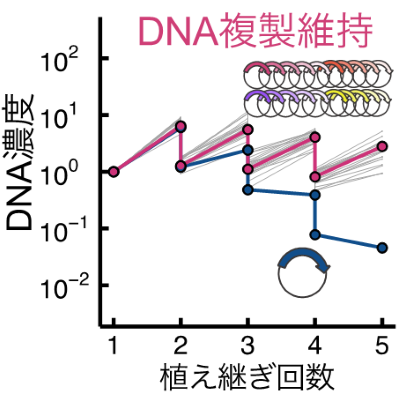
以上の反応では、DNA複製、転写、翻訳という細胞の持つ主要な反応を試験管内で再構成し、しかも、その中でDNA複製と翻訳にかかわる20種類のタンパク質を再生産することに成功しています。先行研究では13種類の翻訳タンパク質の再生産しかできておらず、またDNAも毎回外部から添加されていましたが、本研究では13種類を20種類まで増やし、さらにDNAも反応中に複製することで外部からの供給を不要としています。本研究成果は、自律増殖する人工分子システムへと近づく大きな一歩だと考えています。
〈今後の展望〉
現在のシステムは、20種類のaaRSの遺伝子を持つDNAの複製とタンパク質の再生産が共役していますが、完全な自律的な増殖には、まだ他の翻訳因子、RNA合成酵素、リボソーム、tRNAもDNAから発現させ再生産させる必要があります。そのためには今後、本研究で用いたDNAにこれらの遺伝子を導入していき、本研究で開発したシステムを拡張していくことが必要になります。さらにこのシステムは、本研究グループがこれまでに行なってきた油中液滴を用いた進化実験(注4)と組み合わせることで、より高効率な翻訳タンパク質を進化させられる可能性があります。つまり、本研究で開発した人工分子システムをコアに据えることで、自律的に増殖する人工細胞の構築や無細胞翻訳系の改善につながることが期待されます。
そのような自律的に増える分子システムができれば、現在、生物に頼っている医薬品開発や食料生産などをこのシステムに置き換えることができると考えられます。生物の動作原理にはまだブラックボックスが多く残されているため、生物を使ったもの作りには常に制限が付きまといます。一方で人工的に構築した分子システムであれば、必要な要素しか入っておらず、全て既知の物質で作ることができるため設計や制御が容易になります。将来的には、このような人工システムを使うことで、生物を使っている現状の有用物質の生産をより高い制御性で安定的に行うことを目指しています。
〈関連のプレスリリース〉
「細胞外で複製し進化する人工ゲノムDNAを開発」(2021/11/16)
https://www.u-tokyo.ac.jp/focus/ja/press/z0109_00024.html
発表者
東京大学 大学院総合文化研究科 広域科学専攻
萩野 勝己(博士課程)
市橋 伯一(教授)<東京大学 大学院総合文化研究科 附属先進科学研究機構/東京大学 生物普遍性連携研究機構>
論文情報
雑誌:ACS Synthetic Biology
題名:In vitro transcription/translation-coupled DNA replication through partial regeneration of 20 aminoacyl-tRNA synthetases
著者:Katsumi Hagino and Norikazu Ichihashi*
DOI:10.1021/acssynbio.3c00014
研究助成
本研究は、戦略的創造研究推進事業 チーム型研究(CREST)「ゲノムスケールのDNA設計・合成による細胞制御技術の創出」研究課題名:「自己再生産し進化する人工ゲノム複製・転写・翻訳システムの開発」(研究代表者:市橋 伯一、課題番号: JPMJCR20S1)の支援により実施されました。
用語説明
(注1)Phi29 DNA 複製酵素
枯草菌のバクテリオファージphi29が持つDNA複製酵素。この酵素はDNAやRNAをプライマーとしてDNA鎖を合成できる。鎖置換活性があるため、2本鎖を分離しながらDNA合成を続けることが可能である。本研究では転写酵素によって作られたRNA断片をプライマーとして複製を行っていると予想される。
(注2)無細胞翻訳系
細胞外でDNAにコードされた遺伝子からRNAを転写し、タンパク質へ翻訳することに必要な全ての因子を含む反応液。本研究では特に、東京大学の上田 卓也 研究室で開発された、全て精製された既知のタンパク質とRNAから構成されている再構成型のもの(PURE system, Shimizu et al. Nature Biotechnology, 2001)を用いているため、不明要素のないシステムになっている。
(注3)アミノアシルtRNA合成酵素(aaRS)
無細胞翻訳系に含まれるタンパク質の1種。各転移RNA(tRNA)の遺伝暗号に対応したアミノ酸を付加させる酵素。20種類のアミノ酸毎に対応した酵素が存在し、RNAを読み取り正確にタンパク質を合成するためには20種類全てのアミノアシルtRNA合成酵素が正確にtRNAにアミノ酸を付加する必要がある。
(注4)油中液滴を用いた進化実験
過去に本グループのメンバーにより達成されていたDNAまたはRNAと無細胞翻訳系を油中液滴に封入して行う実験(Ichihashi et al. Nature Communications, 2013 & Okauchi et al. ACS Synthetic Biology, 2021)。これらの実験は、複製活性の高い遺伝子を持つDNAまたはRNAが液滴内でより多く増える実験設計になっているため、高活性な遺伝子を選択することができる。本研究の成果はaaRSの合成がDNA複製に寄与しているため、この実験を行えば高活性なaaRSの遺伝子を持つDNAを選択できる可能性がある。

