ニュース
![]() 2023.09.01
2023.09.01
【研究成果】微生物が光に反応してカリウムイオンを運ぶしくみの解明と神経科学への応用 ――四半世紀ぶりに発見された全く新規のカリウムイオン選択性のしくみ――
2023年9月1日
東京大学
名古屋工業大学
発表のポイント
- 光に反応してカリウムイオンを選択的に輸送するタンパク質(カリウムチャネルロドプシン:Kalium channelrhodopsin, KCR)の立体構造を、クライオ電子顕微鏡を用いて解明しました。
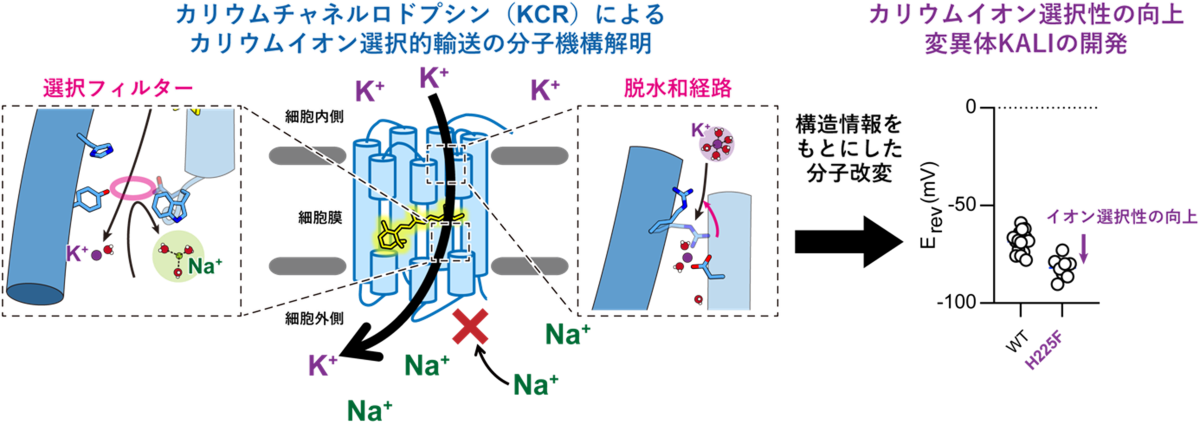
- KCRはイオン透過経路の細胞外側に存在するイオン選択フィルター、細胞内側に存在する脱水和システム、そして生理的条件下において形成されるイオン濃度勾配という3要素を利用することで高いカリウムイオン選択性を実現させているという、既知のカリウムイオンチャネルとは全く異なるKCR独自のイオン選択機構を明らかにしました。
- 立体構造情報に基づき創出した、カリウムイオン選択性をさらに向上させたKCR変異体(KALI)は、次世代の光遺伝学実験を可能にするツールとして神経科学や遺伝子治療の発展に貢献することが期待されます。
発表概要
光刺激によってイオンを輸送する膜タンパク質であるチャネルロドプシン(注1、2)は、実験動物の神経活動を生きたまま光制御する「光遺伝学ツール(注3)」として広く利用されてきました。近年カリウムイオンを選択的に輸送するカリウムチャネルロドプシン(KCR、注4)が発見され、神経活動を抑制する理想的な光遺伝学ツールとして期待されています。しかし、KCRは既知のカリウムイオンチャネルとはあらゆる面で全く異なっており、KCRがどのようにカリウムイオンを選択的に輸送するかは大きな謎となっていました。
東京大学大学院総合文化研究科の但馬聖也大学院生、岸孝一郎大学院生、福田昌弘特任助教、加藤英明准教授、同大学物性研究所の井上圭一准教授、名古屋工業大学大学院工学研究科の杉浦雅大大学院生、片山耕大准教授、神取秀樹特別教授らの研究グループは、クライオ電子顕微鏡(注5)を用いてKCRの立体構造決定に成功しました。電気生理学(注6)、分光学(注7)及び計算科学(注8)を組み合わせることで、KCRは細胞外側の選択フィルター(注9)、細胞内側の脱水和システム、そして生理的条件下で形成されるイオン濃度勾配を利用することにより、高いカリウムイオン選択性を実現していることが明らかとなりました。
既知のカリウムイオンチャネルによるイオン選択性のしくみは1998年にRoderick MacKinnon博士らによって解明され、同氏は2003年にノーベル化学賞を受賞しましたが、本研究成果ではおよそ四半世紀ぶりに、生物が有する全く新たなカリウムイオン選択機構を解明したことになります。さらに、本研究グループが開発したカリウムイオン選択性をさらに向上させたKCR変異体(KALI)は、次世代の光遺伝学実験を可能にするツールとして神経科学や遺伝子治療の発展に貢献することが期待されます。
本研究成果は、2023年8月30日(米国東部夏時間)に米国科学誌「Cell」のオンライン版に掲載されました。
発表内容
〈研究の背景〉
ロドプシンは光を受容する膜タンパク質の一種であり、動物の視覚や微生物の走光性など、多様な生命現象に関わります。このうち、光受容に応じて細胞膜を介したイオン透過を担うイオン輸送型ロドプシンは、遺伝子導入技術や光学系と組み合わせることで、標的細胞の膜電位を高い時空間分解能で光制御することが可能です。この光遺伝学と呼ばれる革新的技術は、神経科学をはじめとする基礎生物学分野だけでなく、近年ではヒト疾患の遺伝子治療にも応用されており、大きく注目されています。
これまで光遺伝学ツールとして実用化されてきたイオン輸送型ロドプシンのうち、中心的役割を果たすのがチャネルロドプシンです。チャネルロドプシンは光受容により開孔して細胞膜を介したイオンの受動輸送を行う光駆動型イオンチャネルです。最初に発見されたチャネルロドプシンはナトリウムイオンをはじめとする様々な陽イオンを非選択的に輸送したことから、神経細胞を光で活性化させる興奮性の光遺伝学ツールとして実用化され、現在も広く利用されています。
この一方で、神経細胞の活動を抑制する「抑制性の光遺伝学ツール」の発展は遅れています。現在用いられている代表的な抑制性の光遺伝学ツールとしては、光刺激により塩化物イオンを細胞内側に輸送する陰イオンチャネルロドプシンが挙げられますが、軸索末端やシナプス終末では細胞内外の塩化物イオン濃度差が逆転しているため、その利用範囲が限定的であるという問題がありました。生理的条件において、神経細胞の活動抑制はカリウムイオンの細胞外への流出に伴う膜電位の再分極によって起こります。このため、カリウムイオン選択的なチャネルロドプシンは理想的な抑制性の光遺伝学ツール候補と考えられてきました。しかし、既知のカリウムイオンチャネルはチャネルロドプシンと様々な点で大きく異なっており、そもそもカリウムイオン選択的なチャネルロドプシンというものが存在し得るのかどうかすら不明でした。
そうした状況下で2022年ついに、自然界よりカリウムイオンを選択的に輸送する2種類のKCR(HcKCR1野生型およびHcKCR2野生型)が発見されました。しかし、KCRはこれまで報告されてきたどのカリウムイオンチャネルとも配列相同性を持っておらず、KCRによる光受容や、そのユニークなカリウムイオン選択性の分子機構は完全に不明でした。
〈研究の内容〉
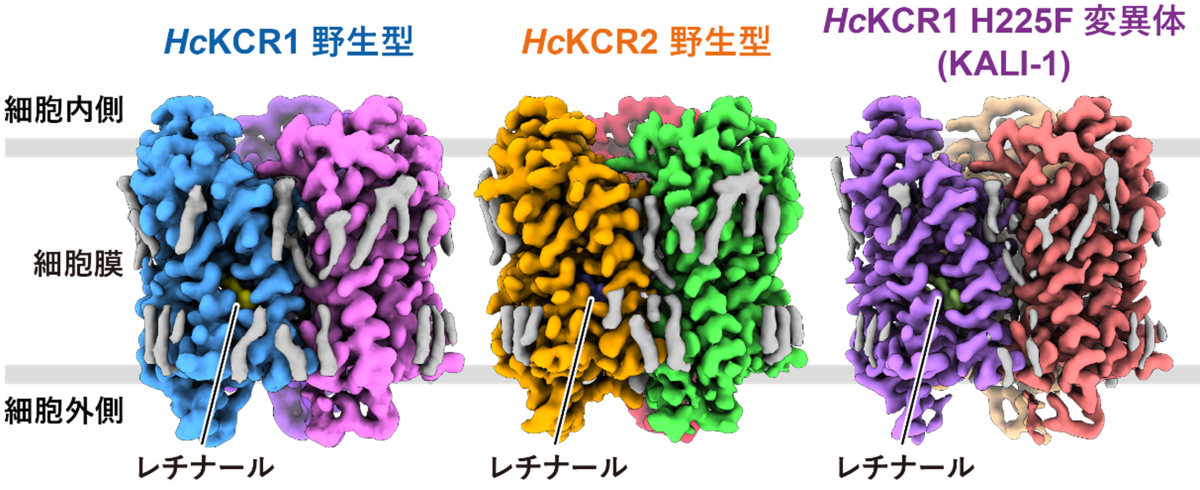
今回、本研究グループは、クライオ電子顕微鏡を用いて、HcKCR1野生型、HcKCR2野生型、そして構造情報をもとにカリウムイオン選択性を向上させたHcKCR1 H225F変異体 (KALI-1) の計3種類の立体構造を分解能2.6 Å、2.5 Å、2.7 Å(1 Åは100億分の1 m)でそれぞれ決定することに成功しました(図1)。これらのKCRはいずれも単量体内に7本の膜貫通へリックスと光応答を担う発色団を形成するレチナール分子を有し、それぞれ3量体を形成していることが明らかとなりました。
今回得られた立体構造から、まずKCRによる光受容の分子機構を考察しました。先行研究から、HcKCR1野生型は緑色光に応答するのに対して、HcKCR2野生型はより短波長側の青色光に応答することがわかっていましたが、このような応答波長の違いがなぜ生じているのかは不明でした。今回得られたHcKCR1野生型とHcKCR2野生型の立体構造を比較すると、発色団を形成するレチナール分子およびその周辺環境に特徴的な違いが存在すること、すなわち、HcKCR1野生型には他のチャネルロドプシン同様all-trans型レチナールが結合していたのに対して、HcKCR2野生型には6-s-cis型と呼ばれる別異性体のレチナールが結合していることがわかりました(図2)。この6-s-cis型レチナールでは、all-trans型と比べてレチナールの先端部分に存在するβ-イオノン環と呼ばれる環構造がねじれており、これによって応答波長の違いが生じていると考えられました。このレチナールのねじれは周辺の2アミノ酸残基の違いに伴う立体障害に起因すると推察されたため、変異体を用いた分光学的解析によりこの仮説を検証し、その実証に成功しました。これらの結果を踏まえ、β-イオノン環近傍のアミノ酸とチャネルロドプシンの応答波長との間に存在する普遍的ルールの一つを解明することができました。
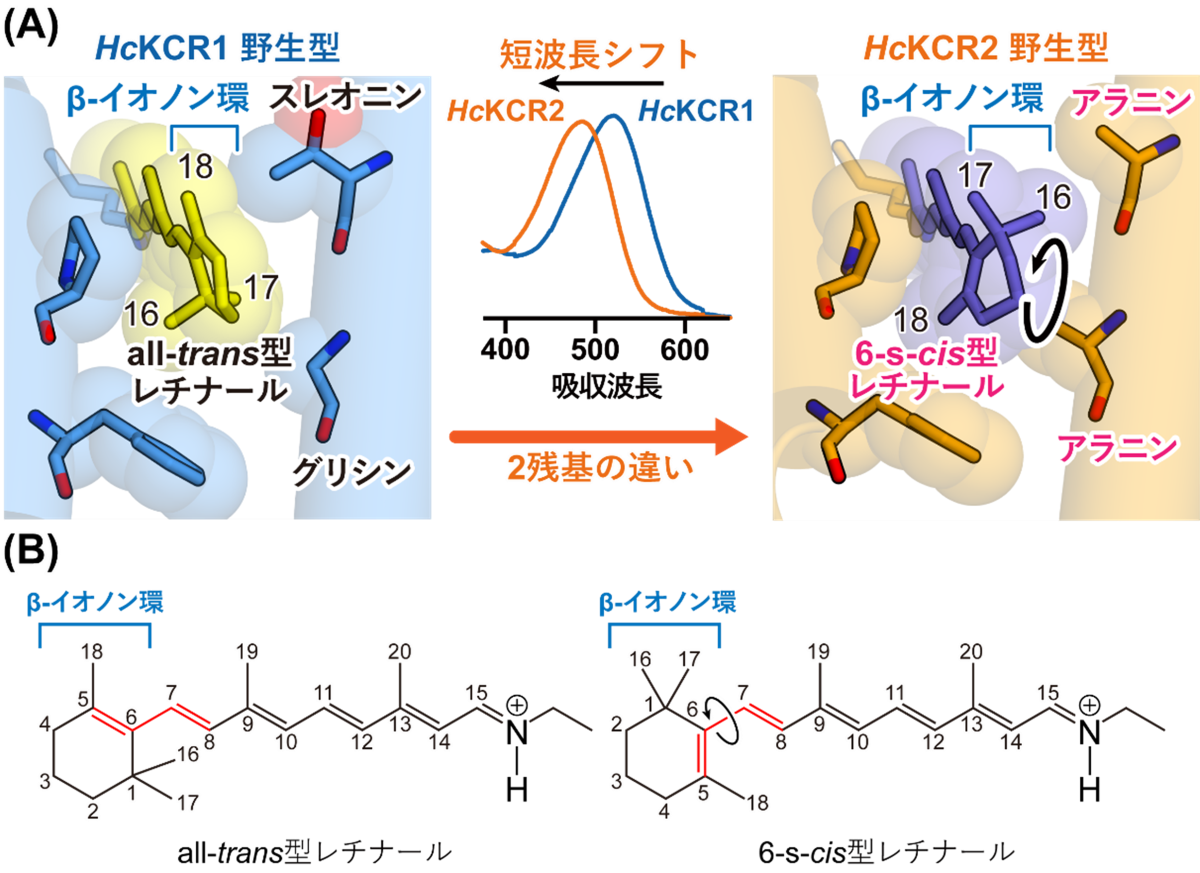
(B) all-trans型(左)と6-s-cis型(右)のレチナールの化学構造。
次に、KCRのカリウムイオン選択機構を明らかにするため、今回得られたKCRの構造と代表的なカリウムイオンチャネルであるKcsAの構造とを比較しました。これまでに報告されてきたカリウムイオンチャネルは、例外なく2量体や4量体といった多量体構造を形成し、多量体界面にイオン透過経路を持っていました。さらに、経路内には対称性の高いイオン選択フィルターを有しており、このイオン選択フィルターによってカリウムイオンの選択的輸送が実現していることが知られていました(図3)。これに対して、KCRのイオン透過経路は3量体界面ではなく単量体にそれぞれ存在しており、その経路の細胞外側にはN99、W102、Y222という3つのアミノ酸残基により特徴的な狭窄部位が形成されていることがわかりました(図3)。さらに電気生理学実験と計算科学実験を組み合わせて解析したところ、この3アミノ酸残基が集まって形成される狭窄部位こそが、KCRにおける独自のイオン選択フィルターであることが明らかになりました。
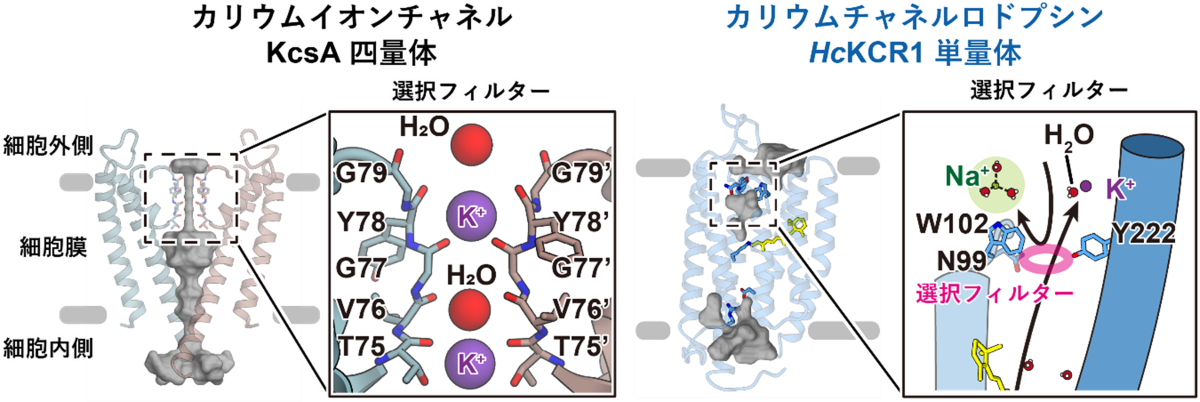
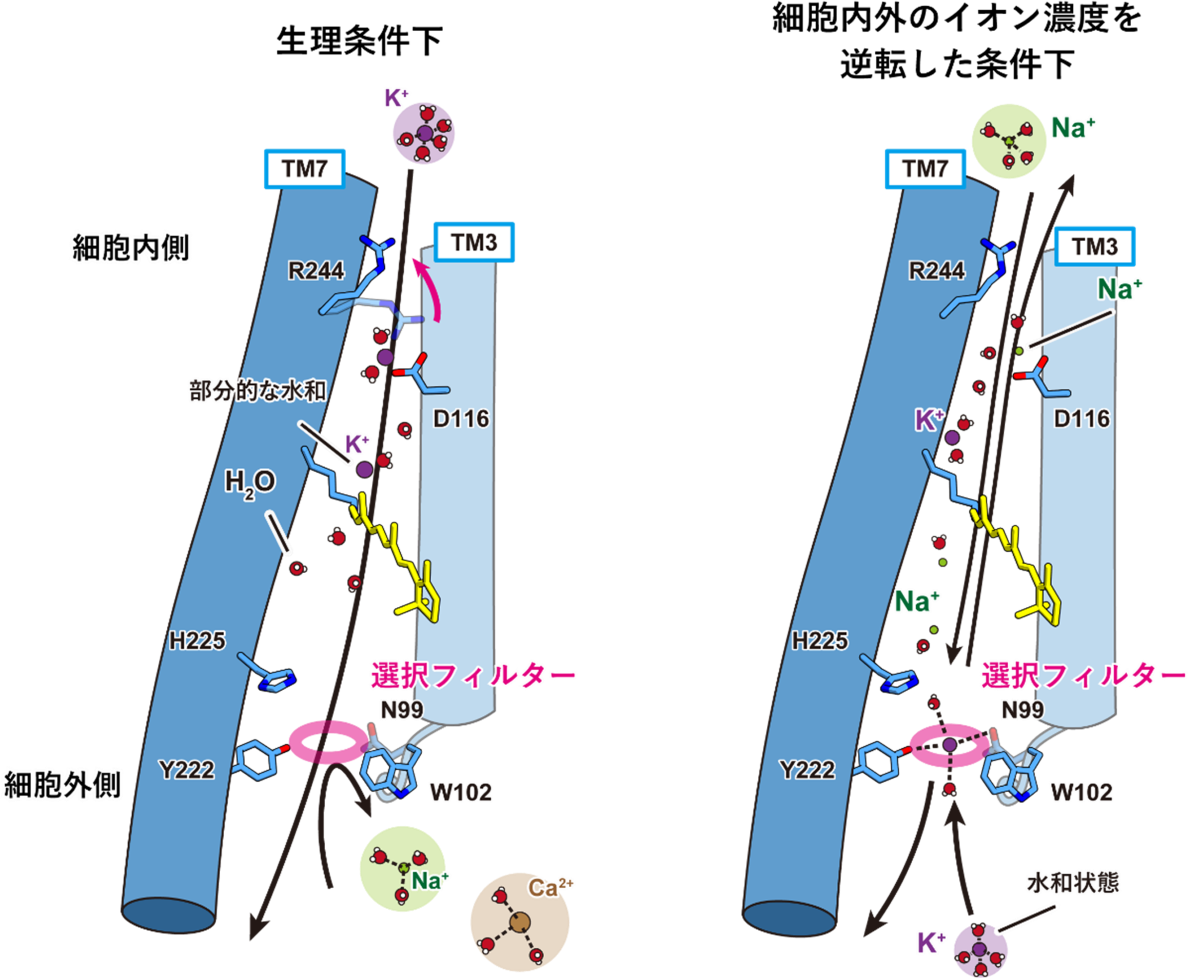
また、さらに電気生理実験を続けたところ、KCRは従来のカリウムイオンチャネルとは異なり、細胞内外のイオン濃度組成を逆転させてナトリウムイオンとカリウムイオンの輸送方向を入れ替えると、カリウムイオン選択性が著しく減少することが判明しました。この、方向依存的なカリウムイオン選択性の分子基盤を明らかにすべく解析を進めたところ、KCRの細胞内側にはイオンの脱水和システムが存在しており、細胞内側からイオン透過経路に侵入したイオンは、それがナトリウムイオンであろうとカリウムイオンであろうと細胞外側に位置する選択フィルターに到達するまでに水和水の一部が剥がされ、選択フィルターを通過しやすくなるということがわかりました。
以上を踏まえ、本研究では以下に記すKCR独自のカリウムイオン選択機構を提唱しました(図4)。生理的条件下、すなわち細胞内側のカリウムイオン濃度が高く細胞外側のナトリウムイオン濃度が高い場合、カリウムイオンは細胞内側から脱水和システムを経てフィルターを通過し、そのまま細胞外側へと流出していく一方、完全水和状態のナトリウムイオンやカルシウムイオンはイオン透過経路の細胞外側に位置する選択フィルターによって弾かれてしまうため、結果としてカリウムイオン選択的なイオン輸送が実現します。しかし、細胞内外のイオン濃度が逆転した条件では、細胞内側からイオン透過経路内に侵入したナトリウムイオンが部分的な脱水和を受けたのちに細胞外の選択フィルターに到達するため、フィルターを通過することが可能となります。カリウムイオンは自由に選択フィルターを通過して細胞内へと輸送されるため、結果的にナトリウムイオンもカリウムイオンも透過する、イオン透過性の低いチャネルとして振る舞うようになると考えられます。
さらに本研究グループは、構造情報をもとに電気生理学的な解析を行い、カリウムイオン選択性を向上させた改良型KCR(K+-selectivity Augmented Light-Gated Ion Channels: KALI)の創出に成功しました。そして、KALI (HcKCR1 H225F変異体) のクライオ電子顕微鏡構造を決定し、計算科学を組み合わせることで、そのカリウムイオン選択性向上のメカニズムを明らかにするとともに、培養細胞や生きたマウスを用いた抑制性の光遺伝学実験を行うことで、KALIがKCR野生型よりも効率的に神経細胞の活動を抑えることができる優れた光遺伝学ツールであることを実証することに成功しました(図5)。
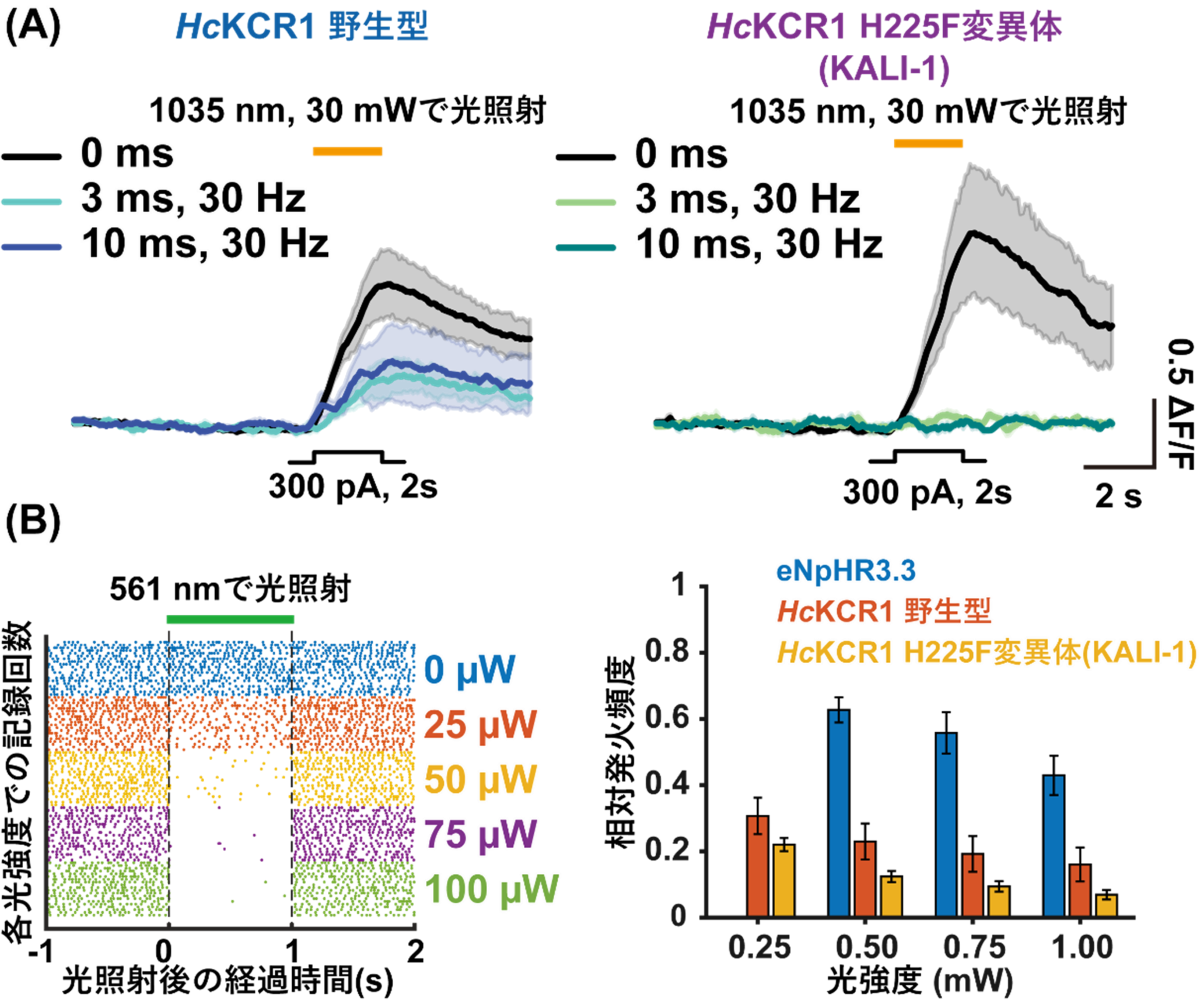
(B) 生きたマウスを用いた大規模神経細胞記録による神経抑制効率の評価実験。(左図)KALI-1を用いた場合の各光強度における神経発火頻度。強度ごとに複数回の神経細胞の発火を記録しており、各記録回における神経細胞の発火が点としてプロットされている。(右図)KALI-1は、従来の抑制性光遺伝学ツールであるeNpHR3.3や、HcKCR1野生型よりも、弱い光強度で効率的に神経細胞を抑制することができる。
〈今後の展望〉
今回本研究グループは、クライオ電子顕微鏡構造解析を基軸に多岐にわたる手法を組み合わせることで、およそ四半世紀ぶりに生物が有する全く新規のカリウムイオン選択機構を明らかにすることに成功しました。さらには、カリウムイオンに対する選択性を一層向上させた光遺伝学ツールKALIの開発を成し遂げました。本研究は生物におけるロドプシンとカリウムイオンチャネルの分子進化に対する理解を促進させただけではなく、本研究において開発されたKALIをはじめとするKCRの有用変異体は、神経科学の発展に貢献し、将来的には光遺伝学を用いた遺伝子治療にも利用されることが期待されます。
〈関連のプレスリリース〉
「新規光駆動型イオンチャネルの構造解明と高性能分子ツールの創出~神経科学に光を当てる~」(2022/02/03)
https://www.u-tokyo.ac.jp/focus/ja/press/z0109_00034.html
発表者
東京大学
大学院総合文化研究科
加藤 英明 (准教授)〈兼:大学院理学系研究科〉
福田 昌弘 (特任助教)
但馬 聖也 (博士課程)
岸 孝一郎 (博士課程)
物性研究所
井上 圭一 (准教授)
名古屋工業大学
大学院工学研究科
神取 秀樹 (特別教授)
片山 耕大 (准教授)
杉浦 雅大 (博士課程)
Stanford大学
Department of Bioengineering
Karl Deisseroth (Professor)
Yoon Seok Kim (Postdoctoral researcher)
YoungJu Jo (Graduate student in PhD program)
Peter Wang (Postdoctoral researcher)
Department of Computer Science
Ron Dror (Professor)
Joseph Paggi (Graduate student in PhD program)
論文情報
雑誌:Cell
題名:Structural basis for ion selectivity in potassium-selective channelrhodopsins
著者:Seiya Tajima, Yoon Seok Kim, Masahiro Fukuda, YoungJu Jo, Peter Y.
Wang, Joseph M. Paggi, Masatoshi Inoue, Eamon F.X. Byrne, Koichiro E. Kishi, Seiwa Nakamura, Charu Ramakrishnan, Shunki Takaramoto, Takashi Nagata, Masae Konno, Masahiro Sugiura, Kota Katayama, Toshiki E. Matsui, Keitaro Yamashita, Suhyang Kim, Hisako Ikeda, Jaeah Kim, Hideki Kandori, Ron O. Dror, Keiichi Inoue, Karl Deisseroth*, Hideaki E. Kato*
DOI:10.1016/j.cell.2023.08.009
研究助成
本研究は、国立研究開発法人科学技術振興機構(JST)「JST 創発的研究支援事業(課題番号:JPMJFR204S)」、「JST CREST(課題番号:JPMJCR21P3)」、「JST ACT-X(課題番号:JPMJAX222F)」、「JST SPRING(課題番号:JPMJSP2108)」、「JSTさきがけ (課題番号:JPMJPR19G4)」、科研費「学術変革領域研究(B)(課題番号:21H05142)」、「基盤研究(A)(課題番号:22H00400)」、「挑戦的研究(萌芽)(課題番号:22K19265)」、「新学術領域研究(研究領域提案型)(課題番号:22H04742)」、「若手研究(課題番号:23K14142)」、「挑戦的研究(萌芽)(課題番号:20K21383)」、「基盤研究(B)(課題番号:21H01875)」、「特別推進研究 (課題番号: 21H04969)」、日本医療研究開発機構(AMED)「脳とこころの研究推進プログラム(課題番号:JP21wm0525018)」、UTEC東京大学未来社会協創基金、中谷医工計測技術振興財団、三菱財団、風戸研究奨励会の支援により実施されました。
用語説明
(注1)ロドプシン
ヒトから微生物まで多くの生き物が持つ光受容タンパク質。共通構造として7本の膜貫通へリックスを有する膜タンパク質であり、中心に光吸収を担う発色団としてレチナールと呼ばれる小分子を結合している。
(注2)チャネルロドプシン
ロドプシンの中でも、光刺激に応じてイオンの電気化学勾配に従ってイオンを輸送する「イオンチャネル」として機能するもの。2002年に藻類から発見された。細胞膜は脂質二重膜で構成されているため本来イオンをほとんど透過できないが、細胞膜中に存在するイオンチャネルと呼ばれる膜タンパク質によって細胞内外の濃度勾配に応じたイオンの輸送が可能となる。
(注3)光遺伝学(オプトジェネティクス)
opto(光)とgenetics(遺伝学)を組み合わせた言葉であり、遺伝学の手法を用いて特定の神経細胞に光受容タンパク質を発現させ、光によって神経細胞の活動を制御する技術。Stanford大学のKarl Deisseroth博士らによって実現された。
(注4)KCR(Kalium channelrhodopsin)
生理的に重要なイオンのひとつであるカリウムイオンを選択的に輸送するチャネルロドプシン。2022年に初めて自然界より発見された (Govorunova et al., Nat. Neurosci. (2022))。報告されたHcKCR1とHcKCR2は、ナトリウムイオンと比較しカリウムイオンに対して約20倍高い透過性を示し、神経を抑制する光遺伝学ツールとしての利用が期待されている。
(注5)クライオ電子顕微鏡
2017年にノーベル化学賞を受賞した技術。一般的な光学顕微鏡とは異なり、極低温環境(クライオ)でタンパク質サンプルに電子線を照射し、その投影像から立体構造を計算して求める手法。この手法によって、タンパク質の構造解析にかかる時間が大幅に短縮され注目を集めている。
(注6)電気生理学
イオンチャネルの性質を調べるための実験技術。透過するイオンの種類(イオン選択性)の他に、チャネルが開いたり閉じたりするまでの時間(キネティクス)、光や電位に対する応答性を詳細に調べることができる。
(注7)分光学
サンプルに光を照射し、その透過光や散乱光を解析することで1原子レベルで分子の状態を調べることができる実験技術。ロドプシンは光を吸収する性質があるため分光学との相性がよく、古くから分光学を用いてロドプシンの分子解析が行われてきた。
(注8)計算科学
実験では調べることが難しいタンパク質の動き(ダイナミクス)や、励起などの量子化学的な現象を計算によってシミュレーションする手法。
(注9)選択フィルター
イオンチャネルに見られる特定のイオンを選択的に透過するための構造。カリウムイオンチャネルの構造は1998年にRockefeller大学のRoderick MacKinnon博士らにより初めて報告され、以降様々なカリウムイオンチャネルの構造が報告されてきた。これまで知られているカリウムイオンチャネルはすべて共通して多量体を形成し、その界面に対称的な構造を有する選択フィルターを有する。この選択フィルターにおいて、カリウムイオンはエネルギー的に最安定な配位構造をとることができる一方で、よりイオン半径が小さいナトリウムイオンはその配位構造が選択フィルター内で不安定化されるため効率的に選択フィルターを透過できない。このようなカリウムイオンチャネルが選択的にカリウムイオンを輸送するしくみの解明をはじめとしたイオンチャネル研究の功績が認められ、同博士を含む2名の研究者が2003年にノーベル化学賞を受賞している。

