ニュース
![]() 2024.06.03
2024.06.03
【研究成果】植物の光を受容する色素は葉緑体の外でも作られる ―これまでの教科書の定説を覆す新発見―
2024年6月3日
東京大学大学院総合文化研究科
発表のポイント
- 植物の光受容体であるフィトクロムの色素団形成に関わるヘムオキシゲナーゼ1が葉緑体だけでなく細胞質でも機能することを初めて明らかにしました。
- 転写開始点制御という新たに発見された制御方法で、1つのヘムオキシゲナーゼ1遺伝子から異なる局在性をもつタンパク質が作られ、生理的に機能することを明らかにしました。
- これまでヘムオキシゲナーゼ1は葉緑体の中だけで合成されると考えられていましたが、教科書の定説を覆す、新たな発見です。
発表概要
植物にとって光は光合成におけるエネルギーとしてだけでなく、環境情報を得るシグナルとしても最も重要な環境因子です。光シグナルは光受容体により感知されますが、光受容体の中でも最も重要なはたらきをするのがフィトクロムです。タンパク質を構成するアミノ酸は可視光を吸収できない(透明である)ため、タンパク質である光受容体が光を吸収するためには色素が必要であり、これを色素団といいます。フィトクロムの色素団はフィトクロモビリンとよばれ、その合成の第1段階はヘムオキシゲナーゼによるヘムの開裂反応です。
東京大学大学院総合文化研究科の増田建教授らのグループは、フィトクロモビリンを合成するヘムオキシゲナーゼ1が、葉緑体だけでなく細胞質にも局在して、実際に機能することを明らかにしました。これまでフィトクロモビリンは、葉緑体の中でのみ合成されると考えられ、教科書にも記載されてきましたが、本研究はこれまでの定説を覆す新発見です。
本研究成果は、2024年5月28日に「Plant Physiology」のオンライン版に掲載されました。
発表内容
① 研究の背景・先行研究における問題点 フィトクロムはタンパク質と色素団が結合することで、機能的な光受容体として機能します。フィトクロムの色素団であるフィトクロモビリンは、ヘムを基質とした2段階の酵素反応により合成されます。第1段階はヘムオキシゲナーゼ(HO)によるヘムの開裂反応であり、第2段階はフィトクロモビリン合成酵素(HY2)により触媒されます。HOもHY2も最初に翻訳されるタンパク質のN末端に葉緑体への輸送配列が存在すること、また植物細胞ではヘムは葉緑体で合成されることから、これまでフィトクロモビリンは葉緑体の中でのみ合成されると考えられてきました。
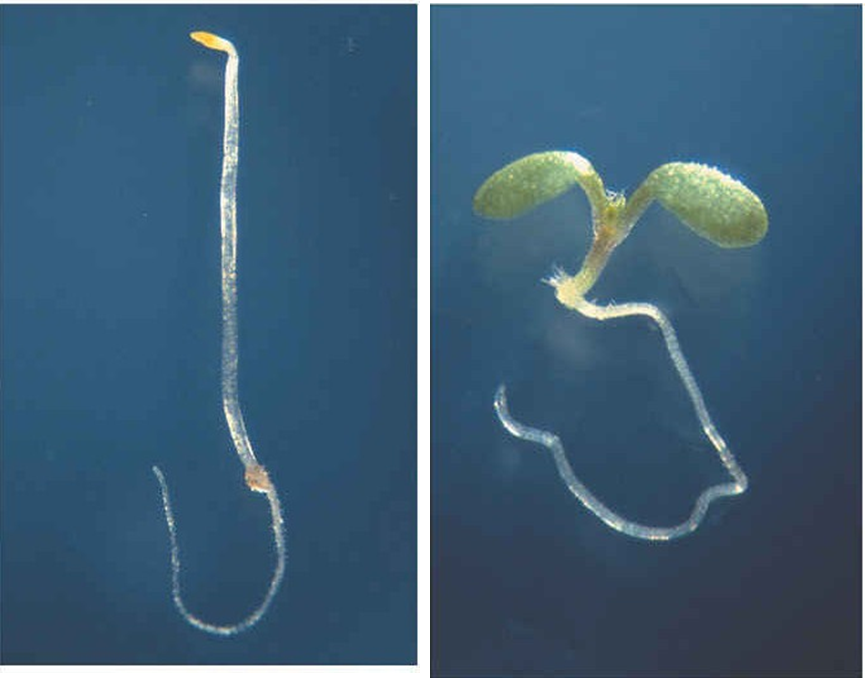
植物の種子は光が届かない土の中で発芽して、地表に達するまでは胚軸(注1)を伸長するような形態形成を行います(暗形態形成)。地表に達して光エネルギーを得られるようになると、子葉が展開・伸長し、さらに葉緑体(注2)が発達して光合成による成長が出来るように形態形成を切り替えます(光形態形成)。このような形態形成のための光シグナルを受容するのがフィトクロムです。フィトクロムには主に暗所芽生えに蓄積し、光により速やかに分解するフィトクロムA(PHYA)と、光条件でもはたらくフィトクロムB(PHYB)が存在します。これまで、フィトクロムは葉緑体で作られるフィトクロモビリンとタンパク質が結合して、光受容体として機能すると考えられてきました。また、HOやHY2は葉緑体の中で、光合成電子伝達系の最終段階にあるフェレドキシンから供給される電子により還元力を得ていると考えられていました。しかし、まだ光合成を行っていない暗所でどのように電子を得て、フィトクロモビリンを合成しているのかは、良く分かっていませんでした。
② 研究内容(具体的な手法など詳細) シロイヌナズナ(注3)のHOには5つの遺伝子が存在します。その中でもHO1が主要なはたらきをすることが知られています。研究グループは、シロイヌナズナとイネにおいて、HO1遺伝子が転写される際に、転写開始点制御(注4)により、葉緑体への輸送配列を含む長い転写産物(HO1L)と、その配列を含まない短い転写産物(HO1S)が作られることを発見しました。さらにHO1Sが暗所や根など光合成を行わない環境や組織で多く作られること、HO1L/HO1S比が光シグナル伝達により制御されることを明らかにしました(図1)
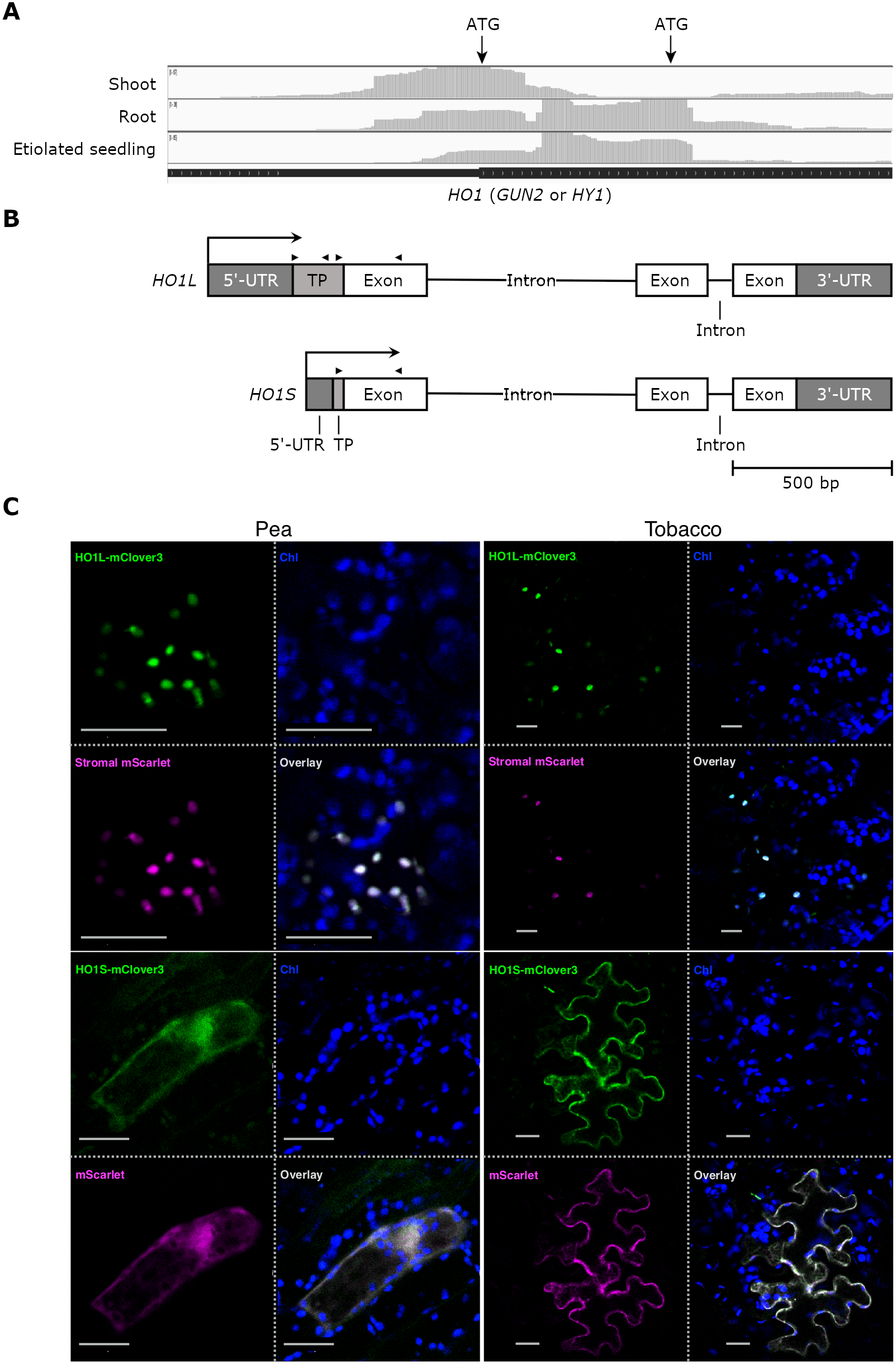
HO1Sは葉緑体への輸送配列を含まないことから、葉緑体内へ輸送できず、細胞質に存在することが予想されました。実際、HO1LとHO1Sに蛍光タンパク質を繋いで観察した結果、それぞれ葉緑体と細胞質に局在することを明らかにしました。さらにこの細胞質型HO1Sが機能しているか、HO1変異体(hy1/gun2-1) に遺伝子を導入して調べました。HO1変異体は殆どのフィトクロモビリンを合成できず、機能的なフィトクロムを作れないことから、光照射をしても胚軸が伸長した暗形態形成の表現型を示します。遺伝子導入の結果、HO1LだけでなくHO1Sもこの表現型を相補して、野生型のように光形態形成できることを見出しました(図2)。

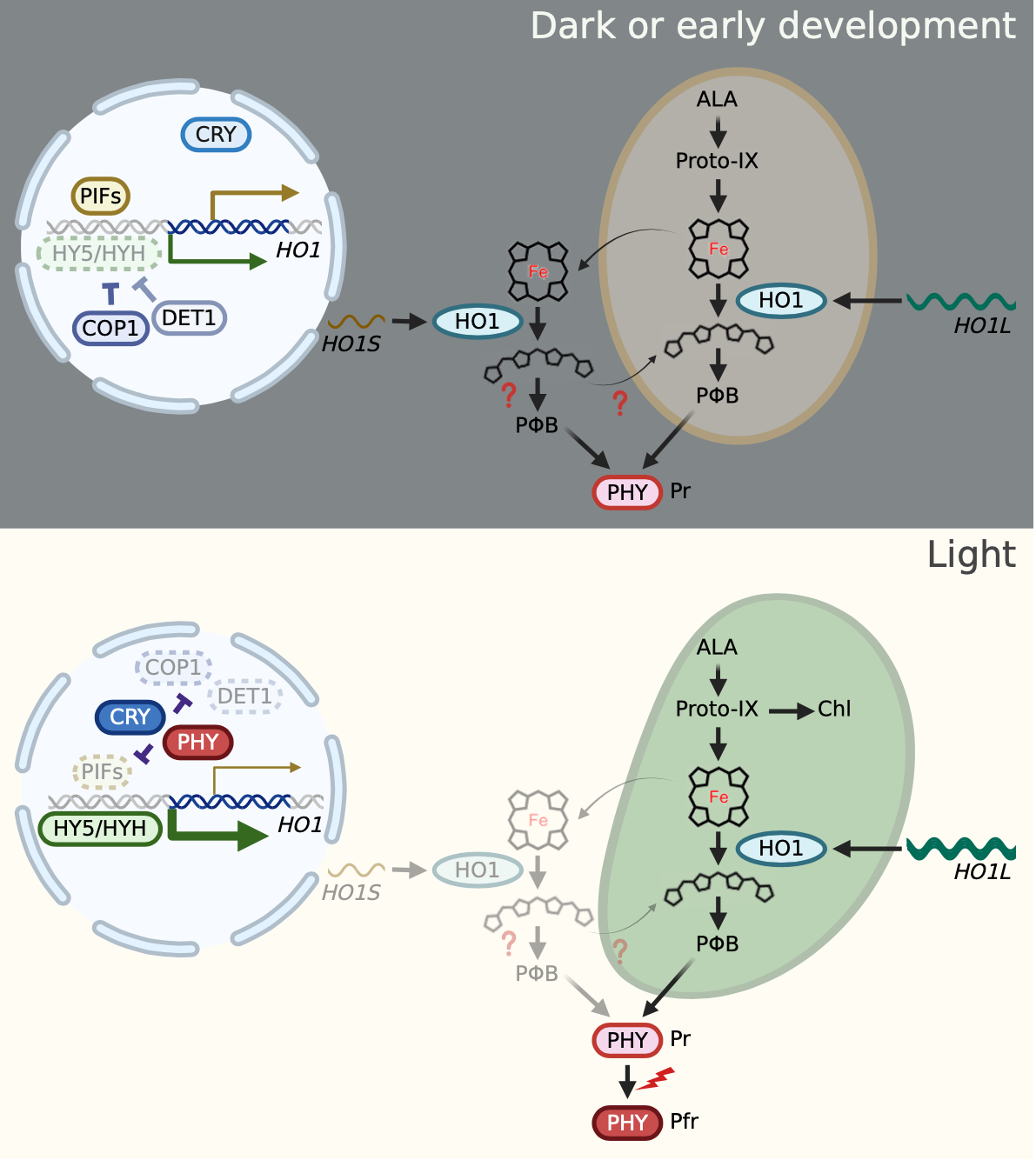
また植物細胞の葉緑体と核の間ではコミュニケーションが行われていると考えられています。特に機能的な葉緑体からは、その状態を核に伝えて、光合成に関連する遺伝子の発現を正に制御するシグナル(レトログレードシグナル)が伝えられていると考えられており、フィトクロモビリンの基質であるヘムがそのシグナル分子であるとの仮説が提案されています。HO1変異体では葉緑体の機能を阻害剤で破壊しても、ヘムを代謝できないことから光合成関連遺伝子の発現が抑制されない表現型(gun表現型)を示すことが知られています。今回、HO1LおよびHO1Sの遺伝子導入により、HO1変異体のgun表現型も相補されることを明らかにしました。これはレトログレードシグナルの実態がヘムであるとする仮説を支持するものであり、これまで不明であったレトログレードシグナル伝達の分子機構についても新たな知見を与える重要な発見であると言えます。
以上の結果から、HO1は葉緑体だけでなく、光合成を行わない環境や組織では細胞質でも機能することが明らかとなりました(図3)。このように光合成が出来ない環境では、HO1は葉緑体のフェレドキシンから電子を得ることが出来ないため、細胞質に局在して、そこに存在する還元物質から電子を得ているのではないかと考えています。このように環境条件に応じて局在性を変化させながら、植物が異なる環境に順化する新たな機構が明らかになりました。また本研究は、これまで葉緑体でのみフィトクロモビリンが合成されると教科書にも記載されていた従来の定説を覆す、新たな発見です。
③ 社会的意義・今後の予定
本研究成果は、植物の光環境適応に新たな知見を与え、光環境に頑健な適応機構を持つ植物の作出応用が期待されます。
今後はHY2の局在についても明らかにしていく予定です。
発表者・研究者等情報
西村 浩二 (島根大学 生物資源科学部 准教授)
時澤 睦朋 (岐阜大学連合農学研究科 博士課程3年(研究当時))
山本 義治 (東海国立大学機構・岐阜大学 応用生物科学部 教授)
岡 義人 (京都大学大学院理学研究科 助教)
松下 智直 (京都大学大学院理学研究科 教授)
花田 耕介 (九州工業大学情報工学研究院 教授)
白井 一正 (九州工業大学情報工学研究院 特任助教)
真野 昌二 (基礎生物学研究所 准教授)
清水 隆之 (東京大学 大学院総合文化研究科 広域科学専攻 助教(研究当時))
増田 建 (東京大学 大学院総合文化研究科 広域科学専攻 教授)
論文情報
雑誌名:「Plant Physiology」(オンライン版:5月28日)
題名:Cytosolic heme catabolism by alternative localization of heme oxygenase 1 in plant cells
著者名:Yingxi Chen, Kohji Nishimura, Mutsutomo Tokizawa, Yoshiharu Y. Yamamoto, Yoshito Oka, Tomonao Matsushita, Kousuke Hanada, Kazumasa Shirai, Shoji Mano, Takayuki Shimizu, Tatsuru Masuda
URL:https://doi.org/10.1093/plphys/kiae288
研究助成
本研究は、科研費「基盤研究(C)(課題番号:JP20K06681)」、「基盤研究(A)(課題番号:JP18H03941)」、「基盤研究(B)(課題番号:JP19H03241)」の支援により実施されました。
用語説明
(注1)胚軸
芽生えにおける子葉から根までを繋ぐ茎の部分。
(注2)葉緑体
植物の細胞内で光合成を担う細胞内小器官。植物の生育初期に原色素体から発達して形成する。特に光合成を行うように分化したものを葉緑体という。葉緑体内部ではチラコイド膜が発達しており、光合成を行う装置が埋め込まれている。
(注3)シロイヌナズナ
アブラナ科の被子植物。2000年に植物として初めてゲノム配列が解読された。多くの変異系統が維持されており、モデル生物としての利点を多く備えていることから、研究材料としてよく用いられている。
(注4)転写開始点制御
遺伝子のDNA配列がmRNAに写し取られる「転写」の際に、その開始点が変化することで、1つの遺伝子から転写されるmRNAの長さにバリエーションが生じる。これにより、転写されたmRNAから合成されるタンパク質が異なる細胞内局在や異なる機能を示すようになる。

