ニュース
![]() 2024.06.18
2024.06.18
【研究成果】光により薬物動態を制御できる新規ホウ素薬剤の開発に成功―ホウ素中性子捕捉療法の適用範囲拡大へ―
2024年6月18日
東京大学大学院総合文化研究科
発表のポイント
- ホウ素中性子捕捉療法(BNCT)に用いる新規薬剤を開発しました。
- 光で薬物動態を制御することにより、臨床で要求される高い腫瘍集積量と血液中からの迅速なクリアランスを同時に達成することに成功しました。
- 本研究成果により、BNCTの適用範囲拡大が期待されます。
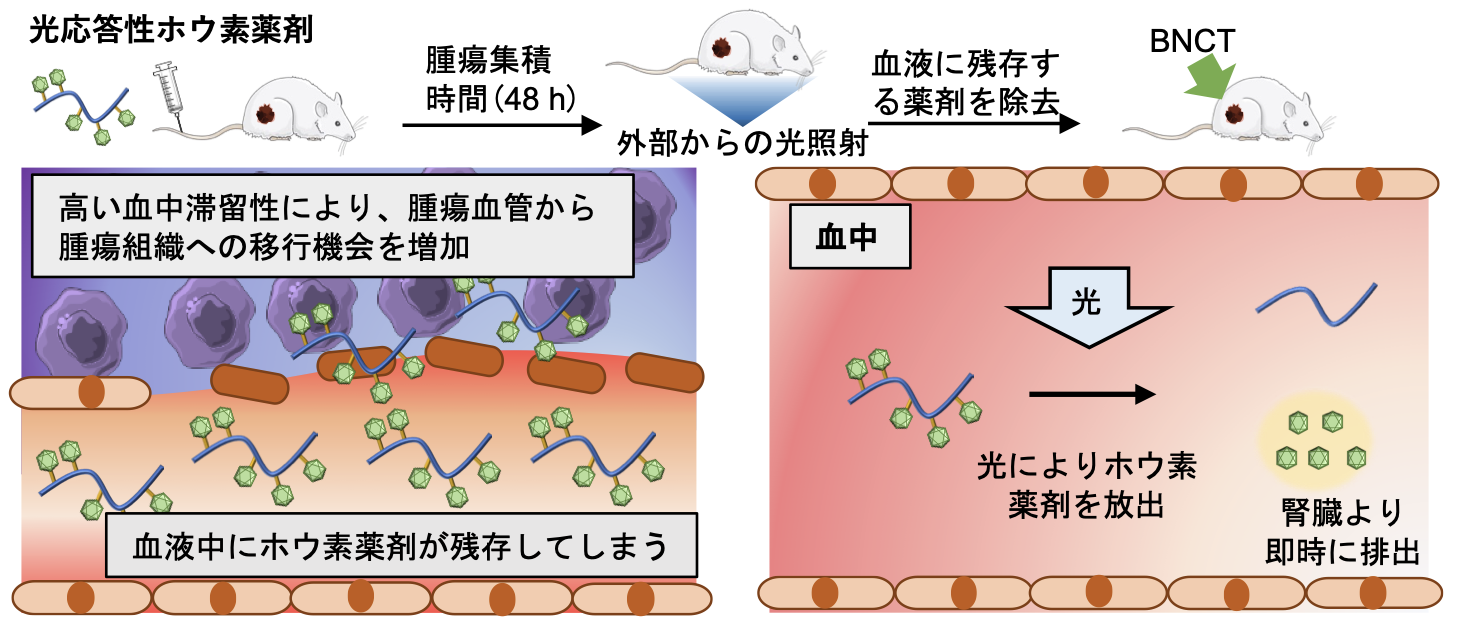
概要
東京大学大学院総合文化研究科の登倉大貴大学院特別研究学生と野本貴大准教授らは、第5のがん治療方法として期待されるホウ素中性子捕捉療法(BNCT)の適用範囲拡大につながる薬剤として、光で薬物動態を制御できるドラッグデリバリーシステム(DDS)を開発しました。BNCTでは、正常組織における被曝量を抑制しながら優れた抗腫瘍効果を得るために、がんに選択的に薬を送り届けて滞留させながら正常組織や血中からは速やかに薬を除去することが求められます。しかし、従来のDDSでは腫瘍に集積しなかった薬が血液中に残存するため、正常組織への被曝量の増大が懸念されていました。この課題を解決するために、本研究では血中に残存してしまった薬を光で除去することができるDDSを世界で初めて開発することに成功しました。本技術により、従来法では対処できなかったがんも治療できるようになることが期待されます。
発表内容
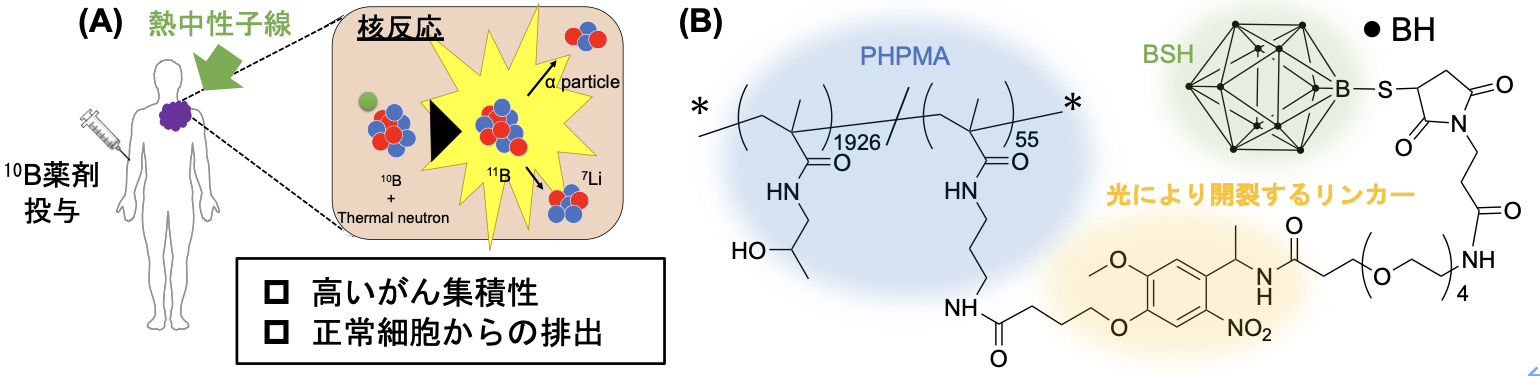
ホウ素中性子捕捉療法(BNCT)(注1)は、熱中性子とホウ素原子(10B)の核反応によりがん細胞を殺傷する治療法です(図1(A))。がんに選択的に十分な量のホウ素を送り届け、そこに熱中性子を照射することにより、正常細胞への影響を最小限に抑えながら、がん細胞をピンポイントで殺傷することが可能です。手術、放射線治療、化学療法といった従来の方法では治すことのできなかった再発性、浸潤性、多発性のがんに対しても根治が期待できる治療法で、第4のがん治療法とされる免疫療法に次ぐ第5のがん治療法として期待されています。2020年には、「切除不能な局所進行又は局所再発の頭頸部癌」に対するBNCTが、世界に先駆け日本で保険適用されました。BNCTは日本発世界に輸出可能な医療技術として大きな期待が寄せられており、その適用範囲の拡大が求められています。
BNCTの適用範囲拡大の成功の鍵を握るのはホウ素薬剤です。現在、唯一承認されているのはボロノフェニルアラニン(BPA)という薬剤です。BPAはLAT1というがん細胞で多く発現しているアミノ酸トランスポーターを介して細胞に取り込まれるため、がんに選択的に集積することができます。しかしながら、LAT1の発現量が少ないがんなどに対しては必ずしも十分に集積できないことがあり、そのようながんに対して選択的に集積することができる新たな薬剤を開発することが必要です。これまでの研究では高分子ミセルやリポソームなどのDDSを用いて、EPR効果(注2)を利用して薬剤を腫瘍に選択的に送達する試みが行われてきました。しかし、そのような従来のDDSは、高いがん集積性を得る前提として薬剤が長期的に血中に滞留する必要がありました。その結果、がんに集積しなかった多くの薬剤は、血液中に残存してしまい、熱中性子照射時に正常組織でも核反応が多く生じ、副作用につながる懸念がありました。
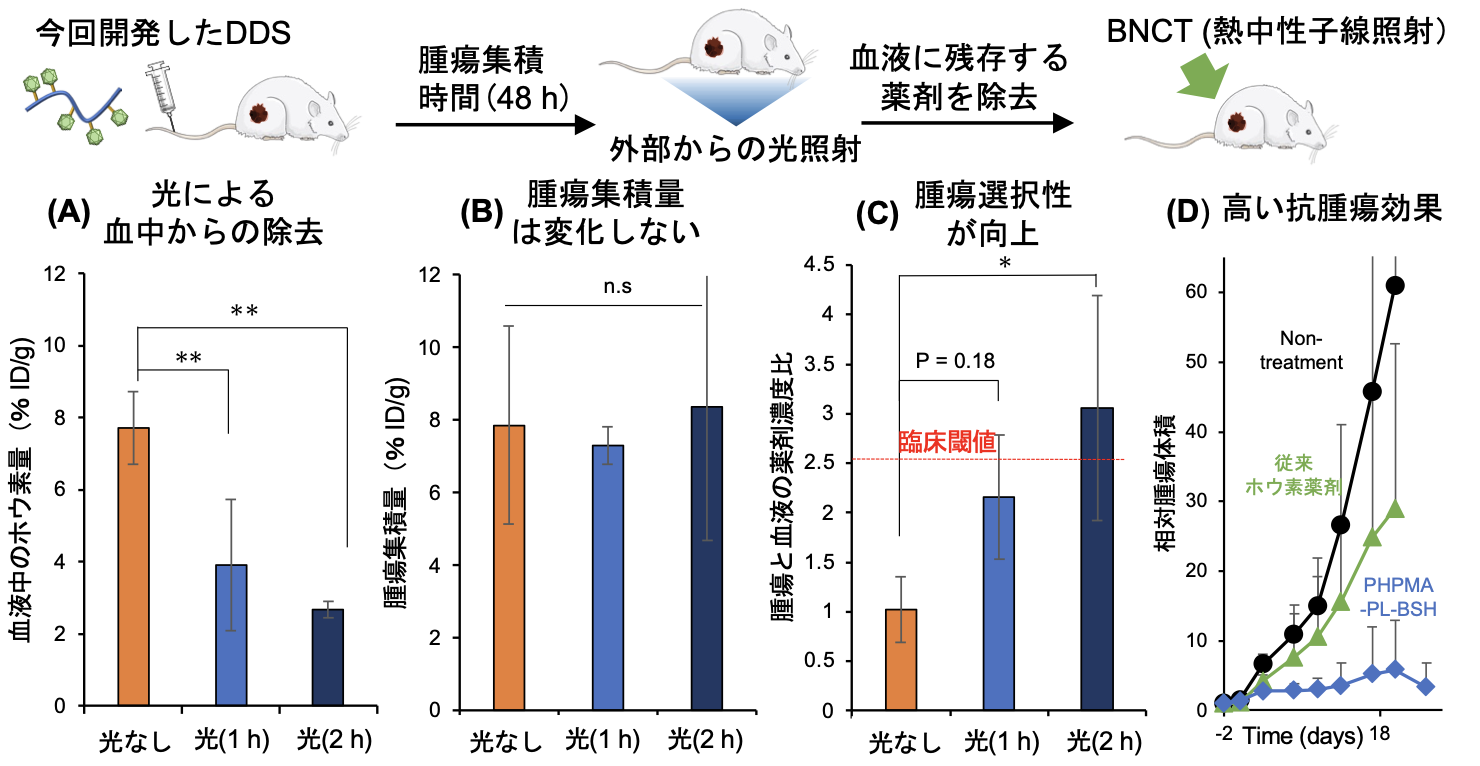
この問題を解決するため本研究チームは、がんに集まらずに血液中に残存してしまった薬剤を、光を利用して速やかに除去できるDDSを開発しました(図1(B))。本DDSは、生体適合性高分子poly(2-hydroxypropyl methacrylate) (PHPMA)誘導体の側鎖に、単剤では即座に腎排泄される低分子ホウ素薬剤(BSH)を、光によって開裂するリンカーを介して結合した構造を持ちます。マウス皮下腫瘍モデルにおいて、静脈注射された本DDSは高い血中滞留性により腫瘍に効率的に集積します。その後、腹部にLEDで光を当てると、血液中に残存してしまったDDSから低分子ホウ素薬剤が切り離され、速やかに尿として排出されます。その結果、臨床に求められる腫瘍選択的集積と血中からの速やかな除去を実現することができました(図2(A-C))。同モデルにおいて臨床の条件を模倣してBNCTを行うと、従来の薬剤と比較して有意に優れた治療効果が得られました(図2D)。光で薬物動態を制御する本研究成果により、BNCTの適用範囲拡大につながることが期待されます。
発表者・研究者等情報
東京大学大学院総合文化研究科
野本 貴大 准教授
登倉 大貴 東京大学特別研究学生
論文情報
雑誌名:Journal of Controlled Release
題名:Active control of pharmacokinetics using light-responsive polymer-drug conjugates for boron neutron capture therapy
著者名:Daiki Tokura, Kakeru Konarita, Minoru Suzuki, Keisuke Ogata, Yuto Honda, Yutaka Miura, Nobuhiro Nishiyama, Takahiro Nomoto
DOI:10.1016/j.jconrel.2024.06.006
URL:https://doi.org/10.1016/j.jconrel.2024.06.006
研究助成
本研究は、科研費(課題番号:JP22H02916, JP20K20196, JP18K18383)、JST創発的研究支援事業(課題番号:PMJFR215E)、AMED橋渡し研究プログラム(課題番号: JP23ym0126803)の支援により実施されました。
用語説明
(注1)ホウ素中性子捕捉療法(boron neutron capture therapy: BNCT)
BNCTは、非常にエネルギーが小さく人体への影響はほとんどない中性子(熱中性子)とホウ素原子(11B、天然のホウ素に約20%含まれる)の核反応で生じる、細胞傷害性の高いアルファ粒子とリチウム反跳核を利用してがん細胞を殺傷する技術です。アルファ粒子とリチウム反跳核の移動する距離は約10 µmであり、丁度細胞1個分の大きさに相当することから、ホウ素原子をがん細胞に選択的に送り届けることができれば、正常細胞に傷害を与えずにがん細胞だけを殺傷することが可能です。そのため、正常組織とがん組織の境界線がはっきりしない浸潤性のがんや多発性のがんに有用であると考えられています。また、アルファ粒子とリチウム反跳核の細胞傷害性の高さ故に、再発性のがんに対しても強い治療効果を期待することができます。
(注2)EPR効果 (enhanced permeability and retention effect)
正常臓器と比較して腫瘍の血管は異常に発達しており、正常血管では見られないようなナノスケールの間隙があるため、高分子ミセルやリポソーム、高分子薬物などのナノスケールの薬剤は、正常血管を透過せず腫瘍血管で選択的に血管外へと漏出すると考えられています。また、腫瘍ではリンパ管の機能が低下しており、一度腫瘍内に浸透したナノスケールの薬剤はしばらく除去されず腫瘍内に長時間とどまるとされています。EPR効果とは、このようにナノスケールの薬剤が腫瘍に集まり留まる現象のことを指します。

