ニュース
![]() 2025.04.04
2025.04.04
【研究成果】20種類の翻訳因子の持続的な再生産を達成 ──自律的に増殖し続ける人工細胞の構築に期待──
2025年4月4日
東京大学
理化学研究所
科学技術振興機構(JST)
発表のポイント
- 生命の根幹的な特徴である自己複製の能力を人工的に再現することは、生命の理解と新しい応用につながる。
- 本研究では、タンパク質合成に必須な20種類のアミノアシルtRNA合成酵素(aaRS)を、試験管内で持続的に再生産することに成功した。
- この成果は自己複製可能な人工細胞の実現に向けた重要な一歩であり、将来的には生物に頼らない効率的で制御性の高い物質生産システムの開発につながる。
概要
JST戦略的創造研究推進事業において、東京大学大学院総合文化研究科広域科学専攻の萩野勝己大学院生、市橋伯一教授(兼:同研究科附属先進科学研究機構/同大学生物普遍性連携研究機構)、理化学研究所生命機能科学研究センターの益田恵子研究員、清水義宏チームディレクターらは、核酸やタンパク質といった無生物材料のみを用いて、生物の必須機能である「タンパク質合成」装置の一部を持続的に再生産する分子システムの構築に成功しました。
生命の特徴である自己増殖の能力を人工的に再現することは、生命科学における重要な課題です。自己増殖を達成するためには、タンパク質の合成機構自体を自ら作り出すシステムが必要ですが、いまだそのようなシステムは構築されていませんでした。今回、本研究グループは、タンパク質合成に必要な20種類のアミノアシルtRNA合成酵素(aaRS)(注1)について、1)遺伝子配列の最適化、2)タンパク質合成システムの組成の改良、3)活性の高い酵素の利用、4)遺伝子発現を阻害する要因の軽減、5) 発現バランスの最適化、という5つの改良を組み合わせ、すべてのaaRSを自ら作り出すことで、元の翻訳活性を維持し続けることのできるシステムの開発に成功しました。
この研究成果は、完全な自己増殖能を持つ人工細胞の実現に向けた重要な一歩となります。今後、このシステムにさらに必要な遺伝子を追加していくことで、将来的には医薬品開発や物質生産などのバイオものづくりに利用可能な、より制御性の高い物質生産システムの開発につながることが期待されます。
本研究成果は、米国東部時間2025年4月2日14時に米国科学誌「Science Advances」のオンライン版で公開されました。
発表内容
<研究の背景と経緯>
栄養を与えるだけで自律的に増える能力は、生物と非生物を隔てる最大の特徴の一つです。生物はこの特別な能力を持っているため、食料や医薬品の安価な生産に利用されてきました。しかし、こうした生物の能力は人間にとって都合よくはできていません。品種改良や遺伝子改変にも手間と時間がかかり、また種が変わるような大規模な改変はできません。もし、生物のように自律的に増える能力を持つ分子システムをゼロから作ることができれば、生物よりも効率的かつ安定的に制御性の高い有用物質生産を行うことができると期待されています。
生物が自身のコピーを作り続けるためには、自身の設計図であるゲノムDNAから情報を読み取り、複製に必要な全てのタンパク質を合成することが必要です。この遺伝情報の読み取り(転写・翻訳)は、多数のRNAやタンパク質を介した化学反応によって起きます。つまり持続的に増え続けるためには、次の世代でもゲノムDNAから遺伝情報の読み取りができるように転写・翻訳にかかわるRNAやタンパク質を再生産する必要があります。しかし、これまでの研究では7種類のタンパク質を24時間まで同時再生産することしかできていませんでした。また発表者らの先行研究(https://www.c.u-tokyo.ac.jp/info/news/topics/20230414070000.html, https://www.jst.go.jp/pr/announce/20230414/pdf/20230414.pdf)では20種類の翻訳タンパク質をDNA複製と共役して発現させましたが、発現量は十分ではなく、持続的な再生産はできておりませんでした。
<研究の内容>
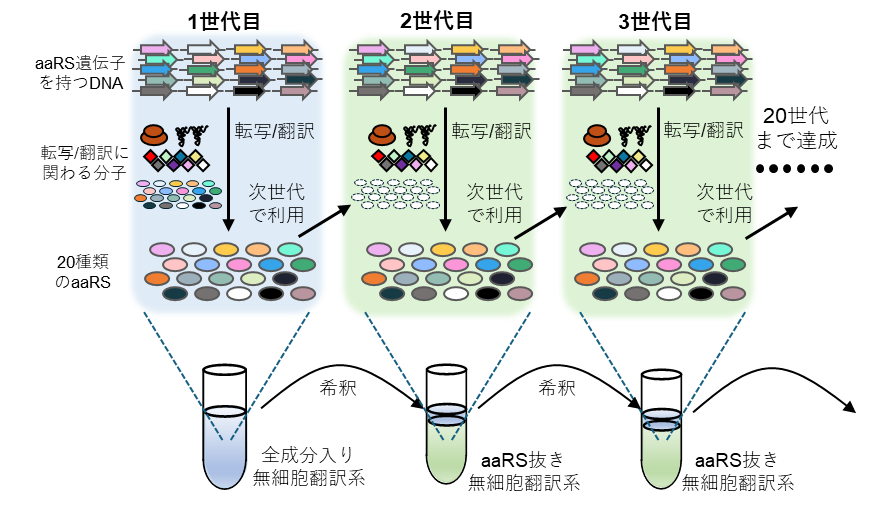
本研究グループは、翻訳に関わるタンパク質のうちリボソームを除き約半数を占める20種類のaaRSを持続的に再生産する分子システムの構築を試みました。大腸菌由来の再構成型無細胞翻訳系(注2)は、任意の遺伝子が載ったDNAを加えることで任意のタンパク質を発現させることができます。そこで本研究では、この無細胞翻訳系を用いて合理的な反応設計と様々な工夫を施すことで20種類のaaRSを最適量で合成し、更なる翻訳反応を続けること(すなわち持続的な再生産)を試みました(図1)。
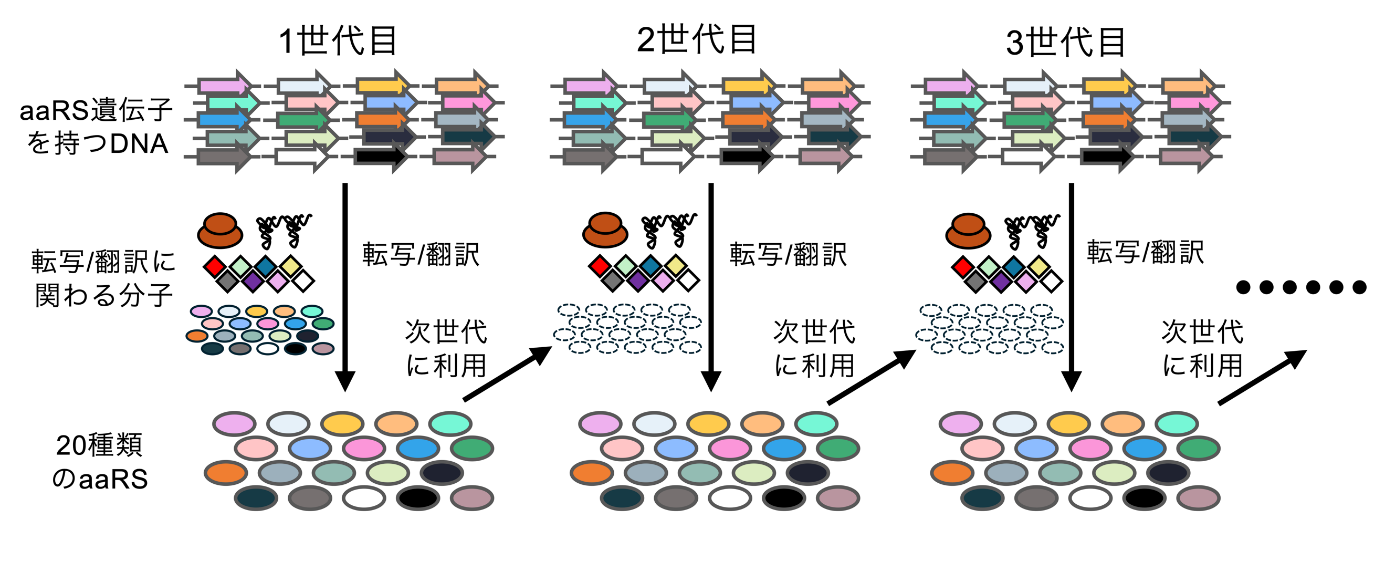
まず20種類のaaRSを無細胞翻訳系で発現させた際の特徴を詳細に解析しました。この解析の結果、20種類のaaRSは翻訳効率とタンパク質あたりの活性がそれぞれ異なり、一部のaaRSは翻訳効率または比活性が平均よりも低いことが分かりました。そこで、翻訳効率の低いaaRSについては、遺伝子配列を改変することで翻訳効率を向上させました。活性の低いaaRSについては、補因子となる亜鉛イオンの添加、および大腸菌以外のバクテリアから高い活性を持つaaRS遺伝子を探索し使うことで活性を上昇させることに成功しました。
そして、上記の改良を用いて、20種類のaaRSを同時に発現させる反応系の設計を行いました。反応設計中の分析の結果、一部のaaRS遺伝子が持つ特定の配列が他のaaRS遺伝子の発現効率を阻害することを突き止め、使用頻度の低いコドンの除去と別の翻訳伸長因子(EF-P)(注4)の添加により、この問題を解決しました。さらに、20種類のaaRSの発現バランスの最適化に取り組み、それぞれの遺伝子(DNA)の量を精密に調整することで、20種類全ての酵素が必要な比率で合成されるようにしました。
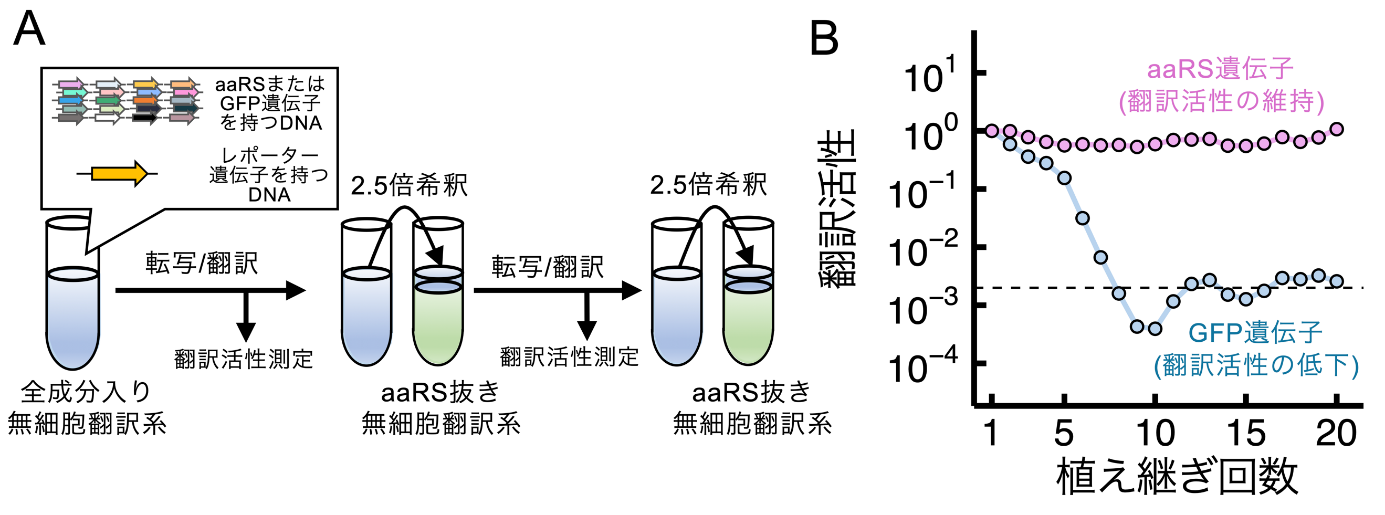
最後に、これら全ての改良を組み合わせて継代(植え継ぎ)実験を行うことで20種類のaaRSが持続的に再生産できているかを検証しました。この継代実験では、1回目の反応は完全な無細胞翻訳系を使って20種類のaaRSを発現させます。その後、全てのaaRSを除去した無細胞翻訳系を用いて1回目の反応液を継代します。もし、1回目の反応で遺伝子発現に必要な量のaaRSが十分に翻訳されていれば、継代後も翻訳反応が持続します。この実験を20回繰り返した結果、aaRS遺伝子を加えない条件(対照区、代わりに緑色蛍光タンパク質(GFP)遺伝子を持つ)では継代するにつれて翻訳活性が低下しましたが、aaRS遺伝子を加えた条件では翻訳活性が維持されました(図2)。この結果は、20種類のaaRSは持続的に再生産でき、最初に入れた酵素が10-8以下に薄められた状態でも、少なくとも160時間にわたり翻訳反応が正常に機能し続けたことを意味します。本研究の成果は、これまでの最高記録であった7種類24時間のaaRSの同時再生産を大きく上回り、また発表者らの先行研究ではできていなかった持続的な再生産を達成するものです。
<今後の展開>
本研究で開発された分子システムは、より複雑な自己複製システムを構築する上での基盤となります。今後は、タンパク質合成にかかわる他の因子(リボソームやtRNA)の合成・再生産や、DNAの複製システムとの統合が次のステップとなります。そして、将来的には本研究で開発した反応系をコアに据えることで自律的に増える人工細胞、あるいは細胞の形をとらないで増える人工生化学システムの構築につながることが期待されます。
このような自律的に増える分子システムができれば、現在、生物に頼っている医薬品開発や食料生産をこのシステムに置き換えることができます。生物の動作原理にはまだブラックボックスが多く残されているため、生物を使ったものづくりには常に制限が付きまといます。一方で人工的に構築した分子システムであれば、必要な要素しか入っておらず、全て既知の物質で作ることができるため設計や制御が容易になります。将来的には、このような人工システムを使うことで、生物に頼らない、より高い制御性と安定性を持ったバイオものづくりを目指していきます。
発表者・研究者等情報
東京大学大学院総合文化研究科広域科学専攻
萩野 勝己 大学院生(博士課程)
市橋 伯一 教授 兼:同研究科附属先進科学研究機構 教授/同大学生物普遍性連携研究機構 教授
理化学研究所生命機能科学研究センター
益田 恵子 研究員
清水 義宏 チームディレクター
論文情報
雑誌名:Science Advances
題名:Sustainable Regeneration of 20 Aminoacyl-tRNA Synthetases in a Reconstituted System Toward Self-Synthesizing Artificial Systems
著者名:Katsumi Hagino, Keiko Masuda, Yoshihiro Shimizu, Norikazu Ichihashi*
DOI:10.1126/sciadv.adt6269
URl:https://www.science.org/doi/10.1126/sciadv.adt6269
研究助成
本研究は、科学技術振興機構(JST)「戦略的創造研究推進事業 チーム型研究(CREST)(課題番号:JPMJCR20S1)」の支援により実施されました。
用語説明
(注1)アミノアシルtRNA合成酵素(aaRS)
無細胞翻訳系に含まれるタンパク質の一種。各転移RNA(トランスファーRNA:tRNA)の遺伝暗号に対応したアミノ酸を付加させる酵素。20種類のアミノ酸毎に対応した酵素が存在し、RNAを読み取り正確にタンパク質を合成するためには20種類全てのアミノアシルtRNA合成酵素が正確にtRNAにアミノ酸を付加する必要がある。
(注2)無細胞翻訳系
細胞外でDNAにコードされた遺伝子からRNAを転写し、タンパク質へ翻訳することに必要なすべての因子を含む反応液。本研究では特に、東京大学の上田 卓也 研究室で清水 義宏(現 理化学研究所生命機能科学研究センター 無細胞タンパク質合成研究チーム チームリーダー)らによって開発された、すべて精製された既知のタンパク質とRNAから構成されている再構成型のもの(無細胞翻訳系, Shimizu et al. Nature Biotechnology, 2001)を用いているため、不明要素のないシステムになっている。
(注3)レポーター遺伝子
細胞翻訳系のタンパク質翻訳能力を簡便に定量するために利用される遺伝子のこと。ここで用いているルシフェラーゼはホタルに由来する発光タンパク質であり、その発光量を定量することにより、ルシフェラーゼタンパク質の翻訳量を定量することができる。
(注4)翻訳伸長因子(EF-P)
リボソームが翻訳中のRNA(mRNA:メッセンジャーRNA)上で停滞していた場合に、その停滞を解消する因子のこと。停滞しやすいアミノ酸配列としてPPP(連続プロリン)などが知られている。

