ニュース
![]() 2025.05.16
2025.05.16
【研究成果】"細胞の履歴"を読み解く: 抗生物質パーシスタンスの多様な生存モード ──細菌の"生き残り方"は一つじゃない──
2025年5月16日
東京大学
発表のポイント
- 独自に開発したマイクロ流体デバイス「MCMAデバイス」を用い、106個の細胞を個別に追跡しながら、抗生物質パーシスタンス現象において生き残る細胞の多様な振る舞いを観察した。
- これまで、抗生物質投与前から細菌集団内に含まれる「成長を止めた細胞」や「ゆっくり成長する細胞」が生き残りやすいと考えられてきたが、抗生物質投与までの環境履歴などに依存して、通常通りに分裂・増殖する細胞が主に生き残る生存モードを確認した。
- 一見、単一のメカニズムで起きているように見える生命現象も、一細胞レベルでは実は複数の異なるメカニズムによって支えられている可能性があり、抗生物質パーシスタンス現象の理解に新たな視点を提供する成果となった。
概要
東京大学大学院総合文化研究科の梅谷実樹特任助教(研究当時)と若本祐一教授らによる研究グループは、独自のマイクロ流体デバイスを用いた観察により、バクテリアの抗生物質パーシスタンス現象(注1)において、抗生物質の種類や環境条件によっては、細胞集団の中で成長の遅い細胞だけでなく、平均的な速度で増殖する細胞も高濃度の抗生物質ストレス下で生き残ることを発見しました。さらに、薬剤投与前の環境条件の履歴に依存して、同じ抗生物質に対しても主要な生存モードが変化したり、一つの集団の中で複数の生存モードが同時に観察されたりすることも明らかになりました。これらの結果は、一見、単一のメカニズムで起きているように見えるパーシスタンス現象が複数の仕組みによって支えられている可能性を示しています。さらに、細胞の振る舞いが過去の環境履歴に影響されることを一細胞レベルで明らかにしたもので、耐性菌出現への理解と対策に新たな視点を提供します。
発表内容
バクテリアのパーシスタンス現象とは、遺伝的に均一な細胞集団を高い濃度の抗生物質に曝しても、一部の細胞が長期間生き残る現象です。これまでの研究では、生き残る細胞の主な要因は「成長が不活発であること」とされてきました。一方で、成長が活発な細胞も生存するという研究成果も蓄えられつつありましたが、その頻度が非常に低いため、生き残る細胞の一細胞レベルでの振る舞いの解明は進んでいませんでした。
本研究では、大腸菌野生株の細胞を様々な培地・成長相(注2)からサンプリングし、独自に開発した「MCMAデバイス」を用いてトータル約100万個の細胞の振る舞いを観察しました(図1, 2)。このデバイスは多数のマイクロチャンバーを並べた構造で、安定した環境下での細胞の培養と、迅速な環境変化を両立させ、細胞集団内で超低頻度で生じる現象を可視化できます。
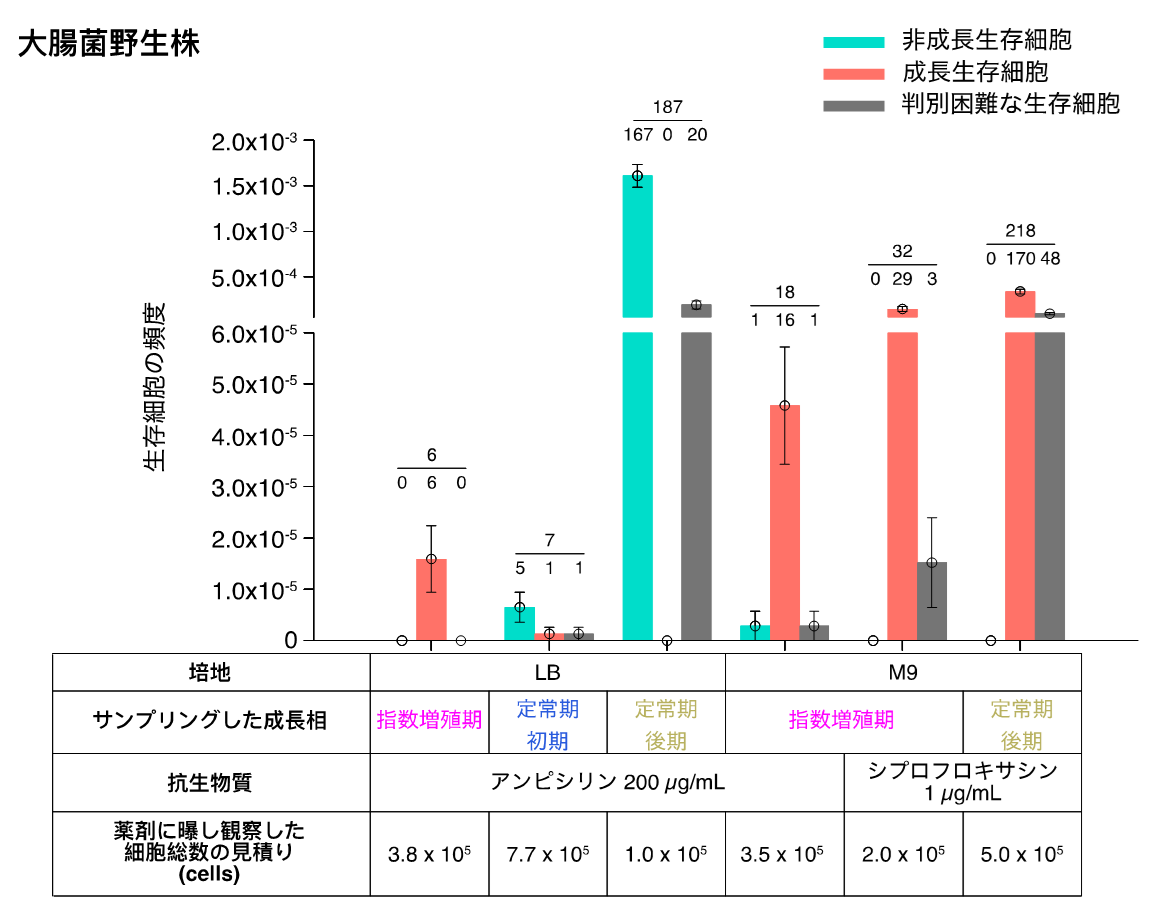
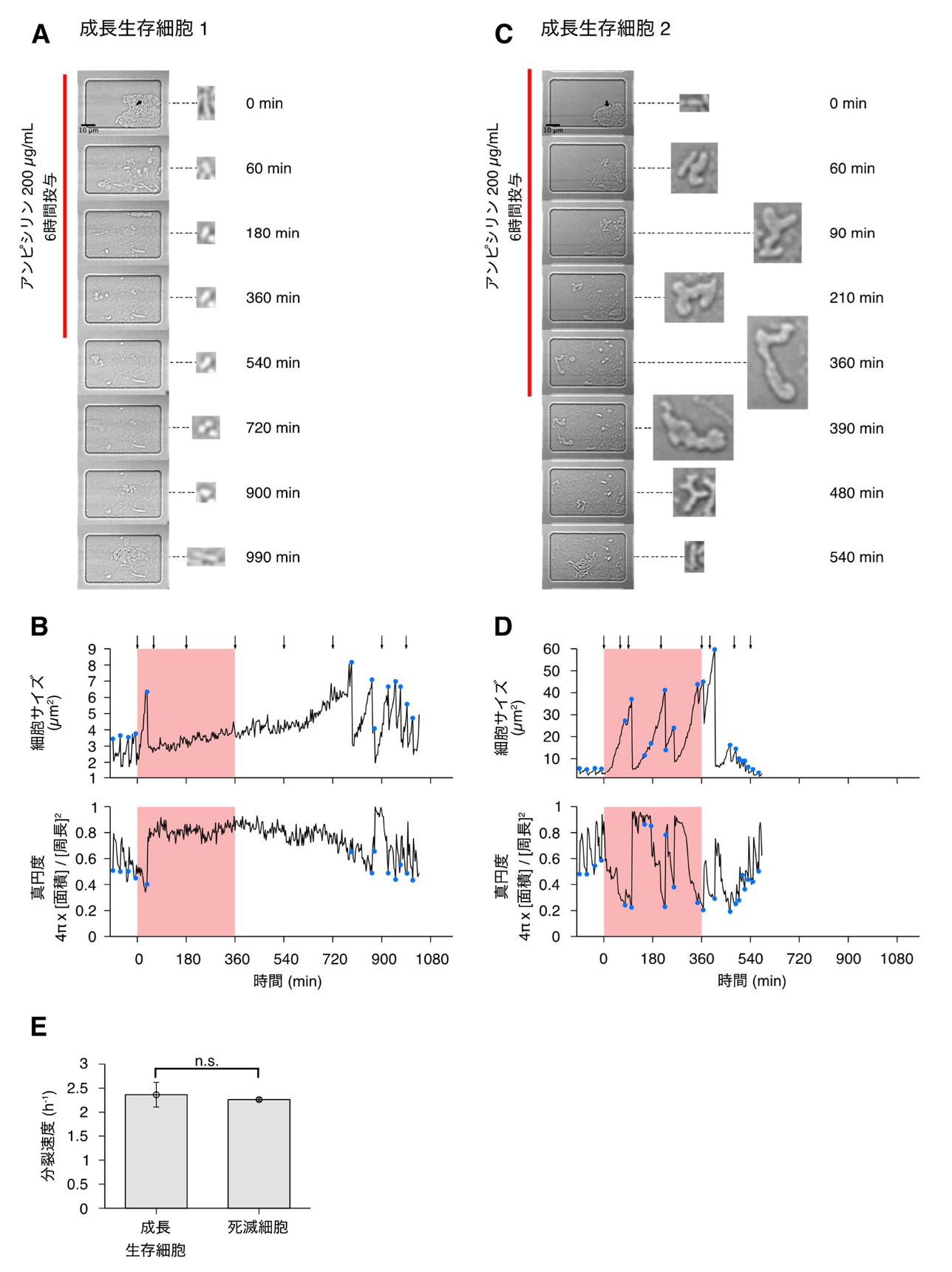
その結果、栄養が豊富なLB培地で指数関数的に増殖していた細胞の中にも、高濃度のアンピシリン(細胞壁合成阻害剤)投与下で生き残るものが存在し、そのほとんどは薬剤投与前に活発に分裂しており(図2, 3)、その分裂速度は死滅した細胞と統計的に有意な差がないことが観察されました(図3)。また、薬剤投与に対して生き延びてくる細胞の薬剤投与中の振る舞いとしては、増殖を一時的に停止する細胞もあれば、細胞壁を失ったL-form(注3)様の柔軟な形態を取りつつ体積を増大させ続ける細胞も観察されました(図3)。
さらに、集団の増殖が停止した段階であるstationary phaseに由来する細胞では、アンピシリンに対しては従来通り、成長が遅い細胞が主に生き残りました。一方、DNA合成阻害剤シプロフロキサシンでは、stationary phaseに由来する細胞でも活発に増殖していた細胞が主に生存していました(図2)。
また、ストレス応答に関わる転写因子であるRpoSのパーシスタンス現象への関与についてこれまで多く議論されていましたが、統一的な結論は得られていませんでした。今回、RpoS機能欠損株のパーシスタンス現象も解析することにより、RpoS機能欠損株の生存頻度や死滅速度は環境やタイミングによって影響を受けるものの、パーシスタンス現象自体は生じ、RpoSの有無は一細胞レベルの振る舞いに関しては、ほとんど影響がないことを明らかにしました。
本研究は、一見、単一のメカニズムによって駆動されているように見えるパーシスタンス現象の背景に、複数の異なるメカニズムが共存すること、また、細胞の振る舞いがその過去の履歴に影響されることを一細胞レベルで実証したものであり、抗生物質耐性の理解や対策に新たな視点をもたらします。
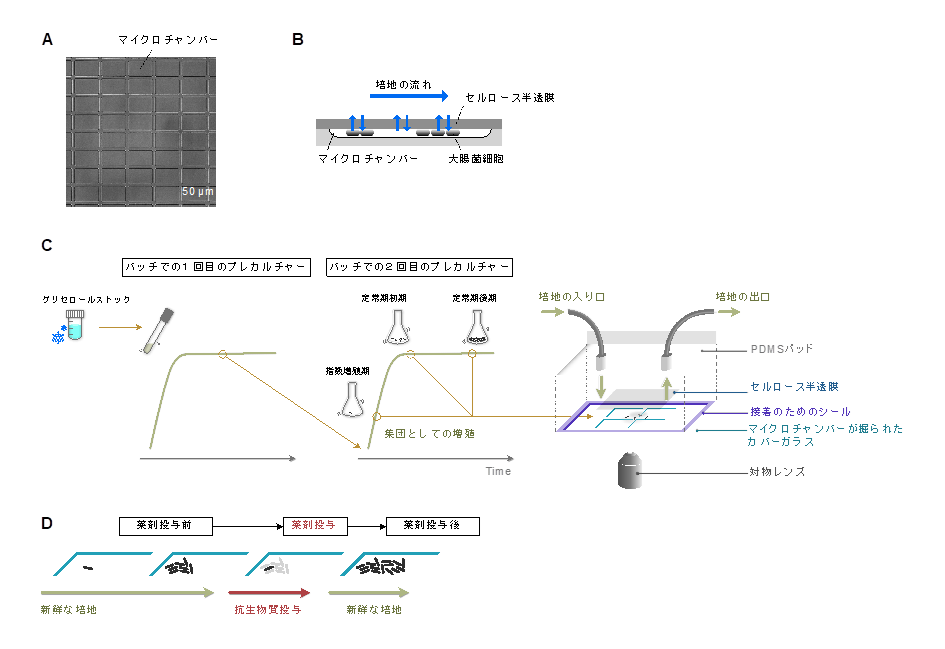
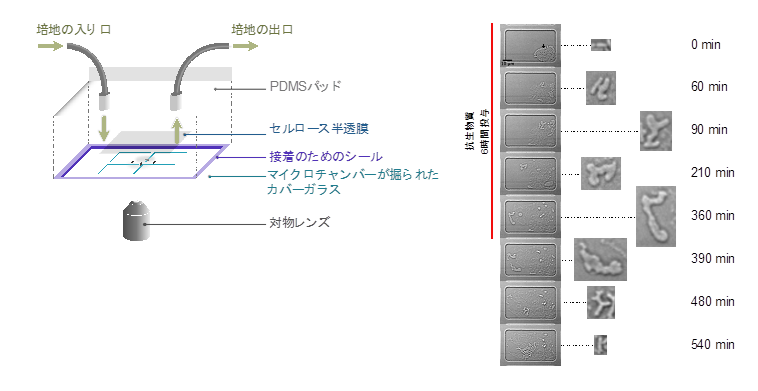
(B) MCMAデバイス内での細胞培養の模式図。細胞はマイクロチャンバー内に保持され、セルロース半透膜で覆われます。培地はメンブレンの上を流れ、半透膜を介してマイクロチャンバー内の培地が交換されます。大腸菌細胞は、マイクロチャンバー内が密になるまで単層で分裂・増殖します。
(C) 細胞のMCMAデバイスへの導入手順。グリセロールストックから回収した細胞を新鮮な培地に接種し、37ºCで一晩振とう培養します(1回目のプレカルチャー)。その後、培地で適切な細胞密度に希釈して再度培養し(2回目のプレカルチャー)、指定したタイミング(指数増殖期、定常期初期、定常期後期)でサンプリングします。サンプルをカバーガラス上のマイクロチャンバー領域にのせ、半透膜で覆うことで、細胞がランダムにマイクロチャンバー内に導入されます。PDMSパッドを周囲に接着シールで取り付け、培地を流します。
(D) タイムラプス観察中の環境変化。細胞はまず新鮮な培地で培養され、その後、抗生物質を含む培地に切り替わります。一定時間抗生物質を投与した後、再び新鮮な培地に戻し、生存細胞の増殖再開の様子を観察します。
成長・非成長生存細胞の頻度
アンピシリンに対する成長生存細胞の振る舞い
(B) (A) に対応する成長生存細胞の細胞サイズ(上)と真円度(下)の時間変化。グラフ上部の矢印は (A) に示した各時刻を対応させています。青い点は細胞分裂、または細胞が千切れたタイミングを示します。薬剤投与中、この細胞は成長・分裂の速度を低下させ、薬剤除去後しばらくしてから、成長を再開しています。
(C) 別の成長生存細胞のタイムラプス観察結果。
(D) (C) に対応する成長生存細胞の細胞サイズ(上)と真円度(下)の時間変化。こちらの細胞は、アンピシリン投与中にL-form様の形態に変化し、細胞サイズを増大させながら過ごしていることが分かります。薬剤除去後には複数回の分裂を経て、元の桿菌状の形態に戻りました。
(E) 成長生存細胞と死滅細胞の、薬剤投与前の分裂速度の比較。エラーバーは標準誤差を示します。両者の間に統計的な有意差は認められませんでした。
発表者・研究者等情報
東京大学大学院総合文化研究科
若本 祐一 教授
梅谷 実樹 研究当時:特任助教 現:ニューヨーク大学生物学科 博士研究員
論文情報
雑誌名:eLife
題名:Observation of persister cell histories reveals diverse modes of survival in antibiotic persistence
著者名:Miki Umetani*, Miho Fujisawa, Reiko Okura, Takashi Nozoe, Shoichi Suenaga, Hidenori Nakaoka, Edo Kussell, Yuichi Wakamoto*
DOI:10.7554/eLife.79517
URL:https://elifesciences.org/articles/79517
研究助成
本研究は、JST CREST「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出(研究総括:松田道行)」における「ライブセルオミクスと細胞系譜解析によるパーシスタンスの理解と制御(課題番号:JPMJCR1927)」、JST ERATO「深津共生進化機構プロジェクト(課題番号:JPMJER1902、研究代表:深津武馬)」、科研費「多様な選択圧下での大腸菌進化実験による揺らぎ-応答関係の定量解析(課題番号:17H06389)」、「細胞複製能の階層横断的理解(課題番号:19H03216)」、「適応的耐性を実現する表現型可塑性と適応進化(課題番号:24H00552)」、NIH Grant「Revealing Stochastic Switches in Bacteria (Grant number: R01-GM097356)」 の支援により実施されました。
用語説明
(注1)抗生物質パーシスタンス現象
バクテリアの細胞集団に高濃度の抗生物質を投与すると、生存している細胞数は急激に減少します。しかし、しばらく経つとその減少速度は緩やかになり、減り方が遅くなる現象が見られます。このような細胞数の推移は「パーシスタンス現象」と呼ばれ、後半に残る細胞は初期に死滅した細胞に比べ、より高い耐性を示すと考えられています。
(注2)成長相
バクテリアの細胞集団は、成長過程でさまざまな変化を示し、その増殖速度によって特徴づけられます。細胞密度が低く、栄養が十分にある環境では、細胞は活発に分裂し、「指数増殖期 (Exponential phase)」に入ります。一方、細胞密度が高まり、栄養が枯渇し環境が劣化すると、増殖速度は次第に低下し、定常期(Stationary phase)に移行します。
(注3)L-form
通常、大腸菌の細胞は「桿菌」と呼ばれ、楕円形のシリンダーのような形態をしています。これは細胞壁によって形が制約されているためであり、安定した細胞増殖にも必要とされています。一方、細胞壁を持たない状態でも、アメーバのように不定形の姿で増殖、分裂を行うことがあり、このような形態を「L-form」と呼びます。L-formは、感染症患者の検体から検出された報告もありますが、その形態を維持するには特殊な環境条件が必要と考えられてきました。しかし、本研究では、そのような特別な条件を設定しなくても、一般的な培地環境でL-form様の形態が観察されました。

